你可能感兴趣的试题
H2A在水溶液中的电离方程式为:H2A=H++HA-,HA- H++A2- 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-) 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 0.0l mol·L-l的NaHA溶液pH>2
H++A2- 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-) 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 0.0l mol·L-l的NaHA溶液pH>2
常温下,某难溶物的Ksp为2.5×105 反应2Mg(s)+CO2(g)= (s)+2MgO(s)能自发进行,则该反应的△H < 0 C.NH3•H2O溶液加水稀释后,溶液中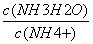 的值减小 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
的值减小 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
一定是酸的溶液 一定是碱的溶液 一定是碱性溶液 可能是酸性溶液也可能是碱性溶液
溶液中由水电离出的c(H+)=1×10-10 mol·L-1 溶液中存在HA H++A- 与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性 原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
H++A- 与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性 原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
c1一定大于0.2 mol·L-1 HA的电离方程式是HA H.++A.- 甲反应后溶液中:c(Na+)>c(OH-)>c(A-)>c(H+) 乙反应后的溶液中:c(Na+)<c(HA)+c(A-)
H.++A.- 甲反应后溶液中:c(Na+)>c(OH-)>c(A-)>c(H+) 乙反应后的溶液中:c(Na+)<c(HA)+c(A-)
①溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) ①溶液中:c(HA)+c(A-)=0.1mol/L 常温下,0.1mol/LHA溶液的pH=1 0.1mol/LHA溶液中:c(HA)>c(A-)
MOH为一元强碱,HA为一元强酸 K点对应的溶液中:c(M+)+c(MOH)=c(A-) K点对应的溶液中:c(MOH)+c(OH-)-c(H+)=0.005mol·L-1 N点水的电离程度小于K.点水的电离程度
PH值一定为5 一定是酸溶液
可能是强酸的酸式盐溶液 PH值可能为9
常温下,HA的电离常数K(HA)约为10-5 v1<20 溶液中水的电离程度:a点>b点 滴定过程为了确定滴定终点,最合适的指示剂是酚酞
-,下列叙述不正确的是( )。 A.溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(A-) 0.10 mol/L的HA溶液中加水稀释,溶液中c(A-)减小 HA溶液中加少量的NaA固体,平衡逆向移动 常温下,加入NaA固体可使HA的电离常数增大
HA溶液中加入NaA固体后, 减小 常温下,0.1mol/LHA溶液中水电离的c(H+)为10﹣13mol/L NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)=c(A﹣)+c(Cl﹣) 常温下,0.1mol/LNaA溶液水解常数为10﹣9
减小 常温下,0.1mol/LHA溶液中水电离的c(H+)为10﹣13mol/L NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)=c(A﹣)+c(Cl﹣) 常温下,0.1mol/LNaA溶液水解常数为10﹣9
常温下,pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 常温下,将pH =10的氨水稀释后,溶液中所有离子浓度都减小 常温下,0.1 mol/L Na2S溶液中存在:c(OH-) = c(H+) + c(HS-) + c(H2S) 常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在: c (Na+) = c(A-) > c(OH-) = c(H+)
HA为一元强酸 MOH为一元弱碱 N点水的电离程度小于K点水的电离程度 K点对应的pH=10,则有c (MOH)+ c(OH-)-c (H+)=0.005mol·L-1
0.1mol·L-1的HA溶液中由水电离出的c(H+)> 1×10-13mol/L c1一定大于0.2 mol·L-1 甲反应后的溶液中:HA占含A-微粒总数的0.01%  乙反应后的溶液中:c(Na+) < c(HA) + c(A-)
乙反应后的溶液中:c(Na+) < c(HA) + c(A-)
常温下,该酸的电离常数K=10-5.6 该测定过程中不可以选择甲基橙为指示剂 离定至①处时,溶液中离子浓度关系为: c(A-)>c(Na+)>c(H+)>c(OH-) 由①到③过程中,水的电离程度先增大后减小
常温下,该酸的电离常数K=10-5.6 该测定过程中不可以选择甲基橙为指示剂 离定至①处时,溶液中离子浓度关系为: c(A-)>c(Na+)>c(H+)>c(OH-) 由①到③过程中,水的电离程度先增大后减小
HA- H++A2- 的电离平衡常数K. = 10-1.2 0.1mol·L-1的H2A溶液中: c(H+) = c(HA-)+c(A2-)+c(OH-)
H++A2- 的电离平衡常数K. = 10-1.2 0.1mol·L-1的H2A溶液中: c(H+) = c(HA-)+c(A2-)+c(OH-)
pH=4.2时, c(HA-)=c(A2-)>c(H+)>c(H2A.)>c(OH-) 常温下,NaHA溶液pH>7
HA为一元强酸 MOH为一元弱碱 N点水的电离程度小于K.点水的电离程度 若K.点对应的溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005 mol·L-1
c1一定大于0.2 mol·L-1 HA的电离方程式是HA H+ +A.- 甲反应后溶液中:c(Na+) > c(OH-) > c(A-) > c(H+) 乙反应后溶液中:c(Na+) < c(HA) + c(A-) ks5u
H+ +A.- 甲反应后溶液中:c(Na+) > c(OH-) > c(A-) > c(H+) 乙反应后溶液中:c(Na+) < c(HA) + c(A-) ks5u

 H++A2- 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-) 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 0.0l mol·L-l的NaHA溶液pH>2
H++A2- 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-) 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 0.0l mol·L-l的NaHA溶液pH>2
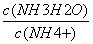 的值减小 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
的值减小 常温下,pH均为5的盐酸与氯化铵溶液中,水的电离程度相同
 H++A- 与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性 原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
H++A- 与0.1 mol·L-1 NaOH溶液等体积混合后所得溶液为中性 原溶液中加入一定量NaA晶体或加水稀释,溶液中c(OH-)均增大
 H.++A.- 甲反应后溶液中:c(Na+)>c(OH-)>c(A-)>c(H+) 乙反应后的溶液中:c(Na+)<c(HA)+c(A-)
H.++A.- 甲反应后溶液中:c(Na+)>c(OH-)>c(A-)>c(H+) 乙反应后的溶液中:c(Na+)<c(HA)+c(A-)
 减小 常温下,0.1mol/LHA溶液中水电离的c(H+)为10﹣13mol/L NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)=c(A﹣)+c(Cl﹣) 常温下,0.1mol/LNaA溶液水解常数为10﹣9
减小 常温下,0.1mol/LHA溶液中水电离的c(H+)为10﹣13mol/L NaA溶液中加入HCl溶液至恰好完全反应,存在关系:2c(Na+)=c(A﹣)+c(Cl﹣) 常温下,0.1mol/LNaA溶液水解常数为10﹣9
 乙反应后的溶液中:c(Na+) < c(HA) + c(A-)
乙反应后的溶液中:c(Na+) < c(HA) + c(A-)
 H++A2- 的电离平衡常数K. = 10-1.2 0.1mol·L-1的H2A溶液中: c(H+) = c(HA-)+c(A2-)+c(OH-)
H++A2- 的电离平衡常数K. = 10-1.2 0.1mol·L-1的H2A溶液中: c(H+) = c(HA-)+c(A2-)+c(OH-) H+ +A.- 甲反应后溶液中:c(Na+) > c(OH-) > c(A-) > c(H+) 乙反应后溶液中:c(Na+) < c(HA) + c(A-) ks5u
H+ +A.- 甲反应后溶液中:c(Na+) > c(OH-) > c(A-) > c(H+) 乙反应后溶液中:c(Na+) < c(HA) + c(A-) ks5u