你可能感兴趣的试题
盐溶液不一定呈中性 碱的组成中一定含有“OH”原子团 物质溶于水时一定伴随着吸热和放热两个过程 中和反应的实质是H.+离子与OH-离子反应生成H2O分子
浓试样比稀试样长 光滑的电极表面和较薄的膜相会缩短响应时间 共存离子对响应时间有影响 一定范围内温度升高会缩短响应时间
浓试样比稀试样长 ; 光滑的电极表面和较薄的膜相会缩短响应时间 ; 共存离子对响应时间有影响 ; 一定范围内温度升高会缩短响应时间
组成盐的酸根对应的的酸越弱或阳离子对应的碱越弱,水解程度就越大(越热越水解) 多元弱酸正盐的水解第一步远远大于第二步 盐溶液浓度越浓,水解程度越大,反之越小 加酸、碱等物质可抑制或促进盐的水解
食盐质量+水的质量=溶液的质量 食盐体积+水的体积=溶液的体积 溶质质量+水的质量=溶液的质量 食盐密度+水的密度=溶液的密度
向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解,则说明原溶液中一定含SO42- 用铂丝蘸取某溶液在无色火焰上灼烧直接观察火焰颜色,未见紫色,说明原溶液中不含K+ 向某溶液中加足量稀HCl,产生的气体能使澄清石灰水变浑浊则说明溶液中一定含CO32- 某溶液中加NaOH溶液,加热产生的气体能使湿润红色石蕊试纸变蓝说明溶液中一定含NH4+
向某溶液中滴加BaCl2溶液,若有白色沉淀,再滴加足量稀HNO3,若沉淀不溶解, 则说明原溶液中一定含SO42- 向某溶液中先滴加硝酸再滴加KSCN溶液,若溶液出现血红色则说明原溶液中含Fe3+ 向某溶液中滴加足量稀HCl,产生的气体能使澄清石灰水变浑浊, 则说明原溶液中一定含CO32-或HCO3- 向某盐溶液中滴加NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体, 则原溶液含NH4+
指针偏左,食盐溶液一定变稀
指针偏右,食盐溶液一定变稀
指针偏左,食盐溶液一定变浓
指针偏右,食盐溶液一定变浓
盐溶液不一定呈中性 碱的组成中一定含有“OH”原子团 物质溶于水时一定伴随着吸热和放热两个过程 中和反应的实质是H.+离子与OH-离子反应生成H2O
溶液都具有均一.稳定.无色透明等性质 10克食盐溶液中溶质的质量分数一定比5克食盐溶液中溶质的质量分数大 50克质量分数为2%的碘酒中含有1克碘 饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液
一定含有硫酸根离子 一定含有银离子 只有硫酸根离子,没有银离子 可能含有硫酸根离子或银离子,或两者都有
指针偏左,食盐溶液一定变稀 指针偏右,食盐溶液一定饱和 指针偏左,食盐溶液一定变浓 指针偏右,食盐溶液一定变浓 
中和反应一定是酸和碱的反应 凡是生成盐和水的化学反应都是中和反应 中和反应的实质是H+和OH―离子结合生成水 中和反应生成的盐溶液不一定呈中性
指针偏左,食盐溶液一定变稀,烧碱潮解 指针偏右,食盐溶液一定饱和,烧碱潮解 指针偏左,食盐溶液一定变浓,烧碱潮解 指针偏右,食盐溶液一定变浓,烧碱潮解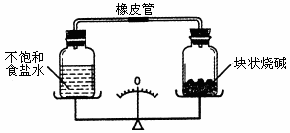
指针偏左,食盐溶液一定变稀,烧碱潮解 指针偏右,食盐溶液一定饱和,烧碱潮解 指针偏左,食盐溶液一定变浓,烧碱潮解 指针偏右,食盐溶液一定变浓,烧碱潮解


