你可能感兴趣的试题
pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) 常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2:三种溶液中NH4+的浓度:②>③>① 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N.前>N后
物质的量浓度相等的 和
和 混合溶液中:
混合溶液中:  常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:  常温下
常温下 相等的①
相等的① 、②
、② 、③
、③ 三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的
三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的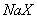 和弱酸
和弱酸 混合后呈酸性的溶液中:
混合后呈酸性的溶液中: 
溶液的pH=9时,溶液中存在下列关系: c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-) NH4HCO3溶液中存在下列守恒关系: c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) 通过分析可知常温下 :Kb(NH3·H2O)<Ka1(H2CO3) 在此溶液中滴加少量浓盐酸,溶液中c(CO32-) / c(HCO3-)减小
)常温下都可用铁制容器贮存 ( )常温下都能与铜较快反应 ( )露置于空气中,溶液质量均减轻 ( )露置于空气中,溶液浓度均降低
醋酸溶液中离子浓度的关系满足:c(H.+)=c(OH-)+c(HCOO-) 0.01mol/L的HCOOH溶液中加水稀释,溶液中c(OH-)减小 HCOOH溶液中加少量的HCOONa固体,平衡逆向移动 常温下pH=2的HCOOH溶液与pH=12的NaOH溶液等体积混合后, pH<7
溶液的pH不变 溶液中Na2CO3的物质的量不变 Na2CO3溶液的浓度不变 Na2CO3的水解程度不变
-,下列叙述不正确的是( )。 A.溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(A-) 0.10 mol/L的HA溶液中加水稀释,溶液中c(A-)减小 HA溶液中加少量的NaA固体,平衡逆向移动 常温下,加入NaA固体可使HA的电离常数增大
醋酸溶液中离子浓度的关系满足:c(H+)=c(OH﹣)+c(CH3COO﹣) 0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH﹣)减小 CH3COOH溶液中加少量的CH3COONa固体,电离平衡逆向移动 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
常温下,在pH=8的NaA溶液中:c(Na+)-c(A-)=9.9×10-7 mol·L-1 由10 mL 0.1 mol·L-1的CH3COOH溶液与10 mL 0.1 mol·L-1的NaOH溶液混合,离子浓度大小的顺序:c(Na+)>c(OH-)>c(CH3COO-)>c(H+) 室温下,由pH=1的CH3COOH溶液与pH=13的NaOH溶液等体积混合,浓度大小的顺序:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 常温下,0.1 mol·L-1 pH=8的NaHB溶液中:c(B2-)>c(H2B.)
-,下列叙述不正确的是 A. 溶液中离子浓度的关系满足:c(H+)= c(OH-)+ c(A-) 0.10 mol/L的HA溶液中加水稀释,溶液中c(OH-)增大 HA溶液中加少量的NaA固体,平衡逆向移动 常温下,加入NaA固体可使HA的电离常数变小
c(H+)>c(OH-)的溶液一定显酸性 将0.1 mol·L-1HI溶液加水稀释l00倍,溶液中所有离子的浓度随之减小 常温下pH=5的硫酸溶液稀释到原来的1000倍,稀释后c(SO42-)与c(H+)之比约为1∶20 常温下的纯水加热到40℃,pH减小
X.溶液浓度可能减小 X.溶液浓度可能不变 X.溶液PH可能增大 X.溶液PH可能减小
常温下都可用铁制容器贮存 常温下都能与铜较快反应 露置于空气中,溶液质量均减轻 露置于空气中,溶液浓度均降低
常温下,该酸的电离常数K=10-5.6 该测定过程中不可以选择甲基橙为指示剂 离定至①处时,溶液中离子浓度关系为: c(A-)>c(Na+)>c(H+)>c(OH-) 由①到③过程中,水的电离程度先增大后减小
常温下,该酸的电离常数K=10-5.6 该测定过程中不可以选择甲基橙为指示剂 离定至①处时,溶液中离子浓度关系为: c(A-)>c(Na+)>c(H+)>c(OH-) 由①到③过程中,水的电离程度先增大后减小
NaHSO3和NaHCO3的中性混合溶液中(S.和C.均用R.表示):c(Na+)= c(HRO3-)+2c(RO32﹣) 常温下将物质的量浓度相等的醋酸钠、醋酸两溶液等体积混合,混合后的溶液中,已知c(Na+)>c(CH3COOH),则:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) 常温下,物质的量浓度和体积都相等的①Na2SO3②Na2SO4③NaHSO4三种溶液中离子总数:①<②<③ 常温下,①pH=3的HCl溶液和pH=11的氨水等体积混合液 ②pH=3的HCl溶液 ③pH=11 的氨水中由水电离出的c(H+):①>③>②
常温下,等浓度的CH3COONa溶液和NaCN溶液的PH前者较小 在NaCN溶液中:c (Na+)+ c (H+) =c (OH-)+ c (CN-) 相同温度下,相同PH的CH3COOH和HCN溶液分别加水稀释,溶液PH随溶液体积变化的曲线如图1所示 常温下,CH3COONa溶液和NaCN溶液中由水电离出的c(OH-)与盐浓度的变化曲线如图2所示
常温下将物质的量浓度相等的醋酸钠、醋酸两溶液等体积混合,混合后的溶液中,已知c(Na+)>c(CH3COOH),则:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
NaHSO3和NaHCO3的中性混合溶液中(S.和 均用R.表示):C.(Na+)=c(HRO3-)+2c(RO32-)
C.常温下,物质的量浓度和体积都相等的①Na2SO3②Na2SO4③NaHSO4三种溶液中离子总数:①<②<③
常温下,①pH=3的HCl溶液和pH=11的氨水等体积混合液②pH=3的HCl溶液③pH=11的氨水中由水电离出的c(H.):①>③>②
常温下,pH等于14与pH等于12的两种NaOH溶液等体积混合后, c(H+)=(10-14+10-10)/2 常温下,浓度为1×10-10 mol·L.-1的KOH溶液的pH为7 氨水加水稀释,溶液中除水以外的所有粒子的浓度都减小 常温下,pH等于1的盐酸溶液中水的电离程度与pH等于13的Ba(OH)2溶液中水的电离程度相等

 和
和 混合溶液中:
混合溶液中:  常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:  常温下
常温下 相等的①
相等的① 、②
、② 、③
、③ 三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的
三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的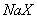 和弱酸
和弱酸 混合后呈酸性的溶液中:
混合后呈酸性的溶液中: 