你可能感兴趣的试题
IA族元素的金属性一定比IIA族元素的金属性强 ⅦA族元素的非金属性是同周期元素中最强的 全部由非金属元素形成的化合物一定是共价化合物 短周期中,同周期元素的离子半径从左到右逐渐减小
IA族元素的金属性一定比IIA族元素的金属性强 ⅥA.族中氢化物最稳定的元素,其最高价含氧酸的酸性也最强 某一元素可能既显金属性,又显非金属性 短周期中,同周期元素所形成的简单离子的半径,从左到右逐渐减小
金属性:Na>K 非金属性:P> 1 C.金属性:Al>Mg 非金属性:O>S
铝片与盐酸反应生成氢气 氢氧化铝溶于强碱溶液 氢氧化铝溶于强酸溶液 铝热反应
IA族元素的金属性一定比IIA族元素的金属性强 ⅥA族元素中氢化物最稳定的其沸点最高 非金属元素只能形成共价化合物 短周期中,同周期元素的离子半径从左到右逐渐减小
钠的金属性比镁强 溴的非金属性比氯弱 硝酸的酸性比磷酸弱 水的热稳定性比氨强
原子最外层电子数小于4的元素一定为金属元素 质子数等于电子数的某微粒,可能是一种分子或一种原子 第ⅠA族元素的金属性一定比第ⅡA族元素的金属性强 非金属元素形成的化合物只有共价化合物
ⅠA.族元素的金属性一定比ⅡA.族元素的金属性强 ⅥA.族元素的氢化物中,稳定性最好的其沸点也最高 ⅤⅡA.族元素中,非金属性最强的元素其无氧酸酸性也最强 第三周期元素的离子半径从左到右逐渐减小
钠的金属性比锂强 碘的非金属性比氯弱 V.A.族中原子半径最小的是氮 第三周期中,金属性最强的是铝
从HF、HCl、HBr、HI的酸性递增的事实,推出F.、Cl、Br、I.的非金属性递增的规律 N.的非金属性比P.强,N2的活动性比磷单质的强 Li、Na、K.的原子半径和单质密度随原子序数的增加而增大 从氢硫酸露空放置容易变质,产生浑浊的事实,推出O.的非金属性比S.强
ⅠA.族元素的金属性一定比ⅡA.族的金属性强 族序数等于周期序数的元素一定是金属元素 全部由非金属元素组成的化合物中只含共价键 13C.和14C.互为同位素,化学性质相似
)有如下经验公式:K=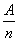 (K.为A.与n的比值)。下列推理正确的是 A.当A.一定时,K.值越小,则元素的非金属性越强 当K=0,则该元素系同一周期中最活泼的金属元素 当n一定时,随着K.值增大,则元素的非金属性逐渐增强强 当K=l时,则该元素系过渡元素,当K.<1时,则该元素系金属元素
(K.为A.与n的比值)。下列推理正确的是 A.当A.一定时,K.值越小,则元素的非金属性越强 当K=0,则该元素系同一周期中最活泼的金属元素 当n一定时,随着K.值增大,则元素的非金属性逐渐增强强 当K=l时,则该元素系过渡元素,当K.<1时,则该元素系金属元素
氮气在常温下是气体,而磷单质是固体 N2在空气中不能燃烧,而磷能在空气中燃烧 NH3极易溶于水,而PH3难溶于水 硝酸比磷酸酸性强
铝片与盐酸反应生成氢气 氢氧化铝溶于强碱溶液 氢氧化铝溶于强酸溶液 铝热反应
钠和镁分别与冷水反应,判断钠和镁金属性强弱 在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属性强弱 硫酸与碳酸的酸性比较,判断硫与碳的非金属性强弱 Br2与I2分别与足量的H2反应的难易,判断溴与碘的非金属活动性强
Al的导电性比Mg强 Al的原子半径比Mg小 Al(OH)3能溶于NaOH溶液,而Mg(OH)2则不能 Mg(OH)2的溶解性比Al(OH)3的溶解性略大
铝片与盐酸反应生成氢气 氢氧化铝溶于强碱溶液 氢氧化铝溶于酸溶液 铝片与硫酸铜溶液反应生成铜
用钠、镁分别与水反应,可证明钠、镁的金属性强弱 用氯化镁、氯化铝分别于浓氨水反应,可证明钠、镁的金属性强弱 用铁、石墨与硫酸铜溶液组成的原电池,可证明铁、铜的金属性强弱 把氯气通入溴化钠的水溶液中,看到溶液呈橙色,可证明氯、溴的非金属性强弱

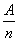 (K.为A.与n的比值)。下列推理正确的是 A.当A.一定时,K.值越小,则元素的非金属性越强 当K=0,则该元素系同一周期中最活泼的金属元素 当n一定时,随着K.值增大,则元素的非金属性逐渐增强强 当K=l时,则该元素系过渡元素,当K.<1时,则该元素系金属元素
(K.为A.与n的比值)。下列推理正确的是 A.当A.一定时,K.值越小,则元素的非金属性越强 当K=0,则该元素系同一周期中最活泼的金属元素 当n一定时,随着K.值增大,则元素的非金属性逐渐增强强 当K=l时,则该元素系过渡元素,当K.<1时,则该元素系金属元素