
 +H2↑ 电解精炼铜的阴极反应式:Cu-2e―=Cu2+ 稀硝酸与过量铁屑反应的离子方程式:3Fe+8H++2NO
+H2↑ 电解精炼铜的阴极反应式:Cu-2e―=Cu2+ 稀硝酸与过量铁屑反应的离子方程式:3Fe+8H++2NO =3Fe2++2NO↑+4H2O
=3Fe2++2NO↑+4H2O
 用浓盐酸酸化的
用浓盐酸酸化的 溶液与
溶液与 反应,证明
反应,证明 具有还原性,发生反应的离子方程式为:
具有还原性,发生反应的离子方程式为: 向小苏打溶液中加入过量的澄清石灰水,发生反应的离子方程式为:
向小苏打溶液中加入过量的澄清石灰水,发生反应的离子方程式为: 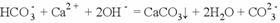 向明矾溶液中滴加
向明矾溶液中滴加 溶液至沉淀质量最大时,发生反应的离子方程式为:
溶液至沉淀质量最大时,发生反应的离子方程式为: 
 H++HCO3ˉ 醋酸与氢氧化钠反应的离子方程式:H.+ + OHˉ
H++HCO3ˉ 醋酸与氢氧化钠反应的离子方程式:H.+ + OHˉ H2O NaHCO3在水溶液中的电离方程式:NaHCO3 = Na+ + H+ + CO32ˉ CuSO4在水溶液中水解的离子方程式:Cu2++2H2O
H2O NaHCO3在水溶液中的电离方程式:NaHCO3 = Na+ + H+ + CO32ˉ CuSO4在水溶液中水解的离子方程式:Cu2++2H2O  Cu (OH)2+2H+
Cu (OH)2+2H+