你可能感兴趣的试题
在某些分子中,化学键可能只有σ键而没有π键 分子中σ键的键能一定大于π键的键能 σ键的特征是轴对称,π键的特征是镜面对称 SO2形成π键与O3的π键是相似的
该物质的分子式为SN 该物质的分子中只有极性键,没有非极性键 该物质分子中N-S键键能很大,故其晶体有很大的硬度 该物质与化合物S2N2互为同素异形体 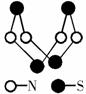
双原子分子中化学键键能越大,分子越稳定 双原子分子中化学键键长越长,分子越稳定 双原子分子中化学键键角越大,分子越稳定 在双键中,σ键的键能要小于π键的
全部由极性键构成的分子一定是极性分子 非极性分子中一定没有极性键 离子晶体中一定没有共价键 分子晶体中一定没有离子键
它们分子中核苷酸的连键性质都是3',5'-磷酸二酯键 只有DNA的连键是3',5'-磷酸二酯键 只有tRNA的连键是3',5'-磷酸二酯键 只有rRNA的连键是3',5'-磷酸二酯键
分子中键的极性越强,分子越稳定 在分子中,化学键可能只有π键而没有σ键 分子中共价键的键能越大,键长越长,则分子越不稳定 若把H2S写成H3S,违背了共价键的饱和性
σ键是原子轨道以“头碰头”的方式相互重叠 共价化合物分子的键能越大,键长越长,则分子越稳定 2个原子形成多个共价键中,只有一个σ键,而π键可以是一个或多个 形成共价键时键与键重叠程度越大,体系能量越底,键越稳定
同主族金属的原子半径越大,熔点越高 同主族非金属元素原子序数越大,其氢化物的沸点越高 构成物质的微料间的作用包括化学键、分子间作用力和氧键三种类型 稀有气体形成的晶体中只有分子间作用力,没有化学键
只有②⑤⑥⑦ 只有②⑤⑥ 只有①②③⑤⑥⑧ 只有②③⑤⑥⑦
含有共价键的化合物一定是共价化合物 只有非金属原子间才能形成共价键 由共价键形成的一定是共价化合物分子 分子中只有共价键的化合物一定是共价化合物
构成单质分子的微粒一定含有共价键 共价键只能存在于共价化合物中 非极性键只存在于单质分子中 共价化合物里一定没有离子键
CH4分子中的键全为σ键而CO2分子中含σ键和π键 σ键是镜面对称,而π键是轴对称 π键是由两个p电子以“头碰头”方式重叠而成 H2分子中含σ键,Cl2分子中含π键
含有π键的分子在反应时,π键是化学反应的积极参与者 当原子形成分子时,首先形成σ键,可能形成π键 有些原子在与其他原子形成分子时只能形成σ键,不能形成π键 在分子中,化学键可能只有π键,而没有σ键
在某些分子中,化学键可能只有π键而没有σ键 当原子形成分子时,首先形成σ键,可能形成π键,配位键都是σ键 σ键的特征是轴对称,π键的特征是镜面对称 含有π键的分子在反应时,π键是化学反应的积极参与者
细胞内ATP和ADP的相互转化为可逆反应 ATP的水解是指ATP分子中高能磷酸键的水解 一个ATP分子中含有一个高能磷酸键 ATP分子中只有高能磷酸键中含有能量
HCl溶于水时H—Cl键会断裂 H2O2分子中只有极性键 NH3是以非极性键结合的分子 MgCl2中既有离子键,又有共价键
π键是由两个p电子“头碰头”重叠形成 σ键是镜面对称,而π键是轴对称 乙烷分子中的键全为σ键而乙烯分子中含σ键和π键 H2分子中含σ键而Cl2分子中还含π键
π键是由两个p电子“头碰头”重叠形成的 σ键是镜像对称,而π键是轴对称 乙烷分子中的键全是σ键,而乙烯分子中含σ键和π键 H2分子中含σ键,而Cl2分子中还含有π键
都是σ键,没有π键 都是π键,没有σ键 既有π键,又有σ键 除CH4外,都是σ键

