你可能感兴趣的试题
若混合后所得溶液呈中性,则HA肯定是强酸、BOH肯定是强碱 若混合前酸、碱物质的量浓度相同,混合后所得溶液呈酸性,则HA肯定是弱酸 若混合前酸、碱pH之和等于14,混合后所得溶液呈碱性,则BOH肯定是弱碱 若混合后所得溶液呈酸性,则混合溶液中离子浓度一定满足: 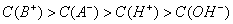
若混合前酸、碱pH之和等于14,则HA一定是弱酸 若混合前酸、碱物质的量浓度相同,则BOH一定是弱碱 溶液中水的电离程度:混合溶液>纯水>BOH溶液 混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
HA为弱酸,BOH为强碱 a点时,溶液中粒子浓度存在关系: c(B.+) > c(Cl-) > c(OH-) > c(BOH) c、d两点溶液混合后微粒之间存在关系: c(H+) = c(OH-) + c(BOH) b点时两种溶液中水的电离程度相同,且V.=20
在0.1 mol·L-1BA溶液中,c(A-)+c(H+)=c(BOH)+c(OH-) 若将0.1mol·L-1BOH溶液稀释至0.001 mol·L-1则溶液的pH=10 若将一定量的上述两溶液混合后pH=7,则混合液中:c(A-)>c(B+) 若将上述两溶液按体积比l:2混合,则混合液中:c(B+)>c(A-)>c(OH-)>c(H+)
K.a(HA)=1×10-6 b点c(B+)=c(A-)=c(OH-)=c(H+) a→c过程中水的电离程度始终增大 c点时, 随温度升高而减小
随温度升高而减小
1 molL -1 0.5 molL -1 .0.6 molL -1 0.4 molL -1
a→c 过程中水的电离程度始终增大 b点时,c(B+)=c(A+)c(H+)=c(OH-) c点时, 随温度升高而减小 相同温度下,Ka(HA)>Kb(BOH)
随温度升高而减小 相同温度下,Ka(HA)>Kb(BOH)
a→c 过程中水的电离程度始终增大 b点时,c(B+)=c(A+)c(H+)=c(OH-) c点时, 随温度升高而减小 相同温度下,Ka(HA)>Kb(BOH)
随温度升高而减小 相同温度下,Ka(HA)>Kb(BOH)
Ka(HA)=1×10-6mol/L b点c (B+)=c(A-)=c(OH-)=c(H+) c点时, 随温度升高而减小 a→c过程中水的电离程度始终增大
随温度升高而减小 a→c过程中水的电离程度始终增大
稀醋酸中加入少量醋酸钠能增大醋酸的电离程度 25℃时,等体积等物质的量浓度的硝酸与氨水混合后,溶液pH=7 25℃时,0.1 mol·L-1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱 PH=2的酸HA溶液与PH=12的碱BOH溶液等体积混合后,所得溶液呈酸性,证明HA为强酸
K.a(HA)=10-6 mol•L.-1 b 点时,c(B+) = c(A-) = c(H+) = c(OH-) c 点时, 随温度升高而减小 a→c 过程中水的电离程度始终增大
随温度升高而减小 a→c 过程中水的电离程度始终增大
BOH溶于水,其电离方程式是BOH=B++OH- 若一定量的上述两溶液混合后pH=7,则c(A—)=c(B+) 在0.1 mol·L-lBA溶液中,c(B+)>c(A.一)> c(OH-)>c(H+) 若将0.1mol·L-lBOH溶液稀释至0.001mol·L-1,则溶液的pH=9
Ka(HA)=1×10-6mol/L b点c (B+)=c(A-)=c(OH-)=c(H+) c点时, 随温度升高而减小 a→c过程中水的电离程度始终增大
随温度升高而减小 a→c过程中水的电离程度始终增大
若混合前酸、碱溶液的pH之和等于14,则HA是强酸
若酸、碱溶液的物质的量浓度相等,则BOH是弱碱
水的电离程度:混合溶液>纯水>BOH溶液
混合后溶液中的离子浓度关系:c(B+)>c(A-)>c(H+)>c(OH-)
BOH一定是弱碱 是浓的弱酸溶液和稀的强碱溶液的混合 混合溶液中的溶质为BA和BOH 混合溶液中水的电离程度较纯水中大
若混合前酸、碱物质的量浓度相同,则HA肯定是弱酸 溶液中水的电离程度:混合溶液>纯水>BOH溶液 若混合前酸、碱pH之和等于14,则HA肯定是弱酸 混合溶液中离子浓度一定满足:c(B+)>c(A-)>c(H+)>c(OH-)
Ka(HA)= 10-6mol·L-1 b 点时,c(B+)/(BOH)= 102 a→b过程中 增大 b→c过程中水的电离程度增大
增大 b→c过程中水的电离程度增大

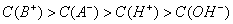
 随温度升高而减小
随温度升高而减小
 随温度升高而减小 相同温度下,Ka(HA)>Kb(BOH)
随温度升高而减小 相同温度下,Ka(HA)>Kb(BOH)
 随温度升高而减小 相同温度下,Ka(HA)>Kb(BOH)
随温度升高而减小 相同温度下,Ka(HA)>Kb(BOH)
 随温度升高而减小 a→c过程中水的电离程度始终增大
随温度升高而减小 a→c过程中水的电离程度始终增大
 随温度升高而减小 a→c 过程中水的电离程度始终增大
随温度升高而减小 a→c 过程中水的电离程度始终增大
 随温度升高而减小 a→c过程中水的电离程度始终增大
随温度升高而减小 a→c过程中水的电离程度始终增大
 增大 b→c过程中水的电离程度增大
增大 b→c过程中水的电离程度增大