你可能感兴趣的试题
的体积可变的密闭容器中通入 ,发生反应A.(s)+2B(g)⇌5C(g)+D(g) △H.<0,在一定温度、压强下达到平衡。平衡时 的物质的量与加入B.的物质的量的变化关系如图。下列说法正确的是 A.图中曲线的斜率表示反应的化学平衡常数 B.若保持压强一定,当温度降低时,θ变大 C.增加A.的物质的量可缩短达平衡所需的时间 若保持容器体积不变,再通入B.,则反应混合物的温度降低
2 mol H2和1 molI.2(g) 3 mol HI 2 molH.2和2 molI.2(g) 1 molI.2(g)和2 mol HI(g)
升高温度,X.的体积分数减小 增大压强(缩小容器体积),Z.的浓度不变 保持容器体积不变,充入一定量的惰性气体,Y.的浓度不变 保持容器体积不变,充入一定量的Z.,X.的体积分数增大
密闭容器中气体的平均相对分子质量不变则该反应达到平衡状态 该反应在任何条件下都能自发进行 再加入一定量氨基甲酸铵,可加快反应速率 保持温度不变,压缩体积,达到新的平衡时,NH3的浓度不变
(s)+3B(g)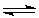 2C(g)+D(g),在一定温度、体积固定的密闭容器中进行,下列叙述中能说明上述反应达到平衡状态的是 A.混合气体的密度不随时间变化而变化 3v正B.= v逆D. D.的物质的量分数在混合气体中保持不变 B.C.D.的分子个数之比为3∶2∶1
2C(g)+D(g),在一定温度、体积固定的密闭容器中进行,下列叙述中能说明上述反应达到平衡状态的是 A.混合气体的密度不随时间变化而变化 3v正B.= v逆D. D.的物质的量分数在混合气体中保持不变 B.C.D.的分子个数之比为3∶2∶1
升高温度,X.的体积分数减小 增大压强(缩小容器体积),Z.的浓度不变 保持容器体积不变,充入一定量的惰性气体,Y.的浓度减小 保持容器体积不变,充入一定量的Z.,X.的体积分数不变
该反应的正反应为放热反应 达到平衡时,容器Ⅰ中的A.体积分数与容器Ⅱ中的相同 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的短 若起始时向容器Ⅰ中充入0.15 molA.0.15 molB.和0.10 molC.则反应将向逆反应方向进行
v(CO2)= v(CO) 容器中总压强不变
容器中混合气体的密度不变 容器中CO的体积分数不变
升高温度,X.的体积分数减小 增大压强(缩小容器体积),Z.的浓度不变 保持容器体积不变,充入一定量的惰性气体,Y.的浓度不变 保持容器体积不变,充入一定量的Z.,X.的体积分数增大
升高温度,X.的体积分数减小 增大压强(缩小容器体积),Z.的浓度不变 保持容器体积不变,充入一定量的惰性气体,Y.的浓度不变 保持容器体积不变,充入一定量的Z.,X.的体积分数增大
升高温度,X.的体积分数减小 增大压强(缩小容器体积),Z.的浓度不变 保持容器体积不变,充入一定量的惰性气体,Y.的浓度不变 保持容器体积不变,充入一定量的Z.,X.的体积分数增大
v (W)消耗=v (W)生成 v正=v逆=0 容器内气体总质量不变 n(M)∶n(N)∶n(W)=1∶1∶2
该反应的正反应为放热反应 达到平衡时,容器Ⅰ中的A.体积分数与容器Ⅱ中的相同 容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的短 若起始时向容器Ⅰ中充入0.15 molA.0.15 molB.和0.10 molC.则反应将向逆反应 方向进行
升高温度,X的体积分数减小 增大压强(缩小容器体积),Z的浓度不变 保持容器体积不变,充入一定量的惰性气体,Y的浓度不变 保持容器体积不变,充入一定量的Z,X的体积分数增大

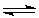 2C(g)+D(g),在一定温度、体积固定的密闭容器中进行,下列叙述中能说明上述反应达到平衡状态的是 A.混合气体的密度不随时间变化而变化 3v正B.= v逆D. D.的物质的量分数在混合气体中保持不变 B.C.D.的分子个数之比为3∶2∶1
2C(g)+D(g),在一定温度、体积固定的密闭容器中进行,下列叙述中能说明上述反应达到平衡状态的是 A.混合气体的密度不随时间变化而变化 3v正B.= v逆D. D.的物质的量分数在混合气体中保持不变 B.C.D.的分子个数之比为3∶2∶1