你可能感兴趣的试题
2c1 = c3 a+b = 92.4 2p2 = p3 α1+α3 = 1
2c1>c3 a+b=92.4 2p2<p3 α1+α3>1
若x<4,则2c1若x=4,则ω1=ω3 无论x的值是多少,均有2ρ1=ρ2内 容器甲中反应从开始到平衡的平均反应速率可能为vA.=0.3mol·L-1·min-1
2c1>c3 a+b=92.4 2p2<p3 α1+α3<1
2c1>c3 a+b=92.4 2p2<p3 α1+α3>1
(g)  2B(g)+C(g),在甲、乙两个容积相同的密闭容器中进行,开始时在两个容器中均放入0.16molA ,甲容器中3min后 的浓度达到0.12mol/L保持不变,乙容器中2min后 的浓度达到0.06mol/L且保持不变,下列说法中正确的是( )A.甲容器中温度比乙容器高B.乙容器中温度比甲容器高C.乙容器中使用了催化剂 甲容器中使用了催化剂
2B(g)+C(g),在甲、乙两个容积相同的密闭容器中进行,开始时在两个容器中均放入0.16molA ,甲容器中3min后 的浓度达到0.12mol/L保持不变,乙容器中2min后 的浓度达到0.06mol/L且保持不变,下列说法中正确的是( )A.甲容器中温度比乙容器高B.乙容器中温度比甲容器高C.乙容器中使用了催化剂 甲容器中使用了催化剂
a+b=92.4 2c1>c3 2p2<p3 α1+α3=1
B.两个密闭容器中,分别充入2molSO2和1mol O2,使它们在相同温度下发生反应:2SO2+O2  2SO3,并达到平衡,在反应过程中,若A.容器保持体积不变, 容器保持压强不变,当A.中的SO2的转化率为25%时,则B.容器中SO2的转化率应是( ) A.25% B.大于25% 小于25% 12.5%
2SO3,并达到平衡,在反应过程中,若A.容器保持体积不变, 容器保持压强不变,当A.中的SO2的转化率为25%时,则B.容器中SO2的转化率应是( ) A.25% B.大于25% 小于25% 12.5%
v1< v2,c2< 2c1 K.1> K.3,p2> 2p3 v1< v3,α1(SO2 ) >α3(SO2 ) c2> 2c3,α2(SO3 )+α3(SO2 )<1
容器①中反应达平衡时,CO的转化率为80% 容器①中CO的转化率等于容器②中CO2的转化率 平衡时,两容器中CO2的浓度相等 容器①时CO的反应速率等于H2O的反应速率
2c1>c3 a+b=92.4 2p2<p3 α1+α3>1
容器乙中反应从开始到达平衡的反应速率为v(H.2)=0.3mol·L-1·min-1 2c1<1.5 在该温度下甲容器中反应的平衡常数K.= 2ρ1=ρ2
2ρ1=ρ2
若 z<4,,2C1 <C2 若 x = 4,则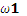 =
=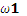 无论x的值是多少贝均有
无论x的值是多少贝均有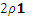 =
=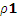 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短
容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短
容器乙中反应从开始到达平衡的反应速率为v(H2)=0.3mol·L-1·min-1 在该温度下甲容器中反应的平衡常数 2c1<1.5 2ρ1=ρ2
2c1<1.5 2ρ1=ρ2

 2B(g)+C(g),在甲、乙两个容积相同的密闭容器中进行,开始时在两个容器中均放入0.16molA ,甲容器中3min后 的浓度达到0.12mol/L保持不变,乙容器中2min后 的浓度达到0.06mol/L且保持不变,下列说法中正确的是( )A.甲容器中温度比乙容器高B.乙容器中温度比甲容器高C.乙容器中使用了催化剂 甲容器中使用了催化剂
2B(g)+C(g),在甲、乙两个容积相同的密闭容器中进行,开始时在两个容器中均放入0.16molA ,甲容器中3min后 的浓度达到0.12mol/L保持不变,乙容器中2min后 的浓度达到0.06mol/L且保持不变,下列说法中正确的是( )A.甲容器中温度比乙容器高B.乙容器中温度比甲容器高C.乙容器中使用了催化剂 甲容器中使用了催化剂
 2SO3,并达到平衡,在反应过程中,若A.容器保持体积不变, 容器保持压强不变,当A.中的SO2的转化率为25%时,则B.容器中SO2的转化率应是( ) A.25% B.大于25% 小于25% 12.5%
2SO3,并达到平衡,在反应过程中,若A.容器保持体积不变, 容器保持压强不变,当A.中的SO2的转化率为25%时,则B.容器中SO2的转化率应是( ) A.25% B.大于25% 小于25% 12.5%
 2ρ1=ρ2
2ρ1=ρ2
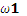 =
=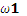 无论x的值是多少贝均有
无论x的值是多少贝均有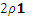 =
=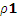 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短
容器甲达到平衡所需的时间比容器乙达到平衡所需的时间短
 2c1<1.5 2ρ1=ρ2
2c1<1.5 2ρ1=ρ2