
外电路中电子由右侧电极移向左侧电极
通入1 mol气体A时,左侧电极上生成5 mol CO2
相同条件下通入气体B与气体C的体积比为2:1
| |


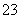 向电极A.移动,且熔融盐c(CO
向电极A.移动,且熔融盐c(CO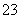 )减小 电极B.上发生的电极反应为:O2+2CO2+4 e-=2 CO
)减小 电极B.上发生的电极反应为:O2+2CO2+4 e-=2 CO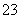
 向正极移动 此电池在常温时也能工作 正极电极反应式为:O2+2CO2+4e-===2CO
向正极移动 此电池在常温时也能工作 正极电极反应式为:O2+2CO2+4e-===2CO
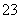 向正极移动 此电池在常温时也能工作 正极电极反应式为O2+2CO2+4e-===2CO
向正极移动 此电池在常温时也能工作 正极电极反应式为O2+2CO2+4e-===2CO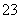 右图为直流电源电解稀Na2SO4水溶液的装置。
右图为直流电源电解稀Na2SO4水溶液的装置。