你可能感兴趣的试题
提高反应物的平衡转化率 改变反应的ΔH. 增大正反应速率,减小逆反应速率 以同样程度改变正逆反应的速率
3v正(N2)=v正(H2) v正(N2)=v逆(NH3) 2v正(H2)=3v逆(NH3) v正(N2)=3v逆(H2)
可逆反应达到平衡的重要特征是各物质的反应速率相等。 在可逆反应里,正反应的速率是正值,逆反应的速率是负值。 对于H2+I2  2HI,当有1mol H-H键断裂的同时,有2mol H-I键生成,说明此可逆反应已达到平衡。 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,这就是该反应所达到的限度。
2HI,当有1mol H-H键断裂的同时,有2mol H-I键生成,说明此可逆反应已达到平衡。 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,这就是该反应所达到的限度。
化学反应速率是对可逆反应而言的,非可逆反应不谈化学反应速率 在可逆反应中,正反应的化学反应速率是正值,逆反应的化学反应速率是负值 同一化学反应中,化学反应速率可用反应物浓度的改变表示,也可用生成物浓度的改变表示,其值可能相同,也可能不同 化学反应速率的单位可以是g/(L·s),也可以是kg/(L·s)
2v正(H2)=3v 逆(NH3) 3v正(N2)=v 正(H2) v正(N2)=v 逆(NH3) v正(N2)=3v 逆(H2)
正、逆反应速度均加快 正、逆反应速度均降低 正反应速度加快,逆反应速度变慢 正反应速度变慢,逆反应速度加快
反应停止 正、逆反应速率都为零 各物质浓度不再改变 反应物的浓度为零
提高反应物的平衡转化率 以同样程度改变正逆反应速率 增大正反应速率,降低逆反应速率 改变平衡混合物的组成
正、逆反应不再进行 反应物的浓度为零 正、逆反应都还在继续进行 正、逆反应的速率相等
各物质的量保持不变 各物质的量继续改变 V(逆=V(正),正逆反应停止 N2 、H2、NH3的速率相等
反应速率越大,平衡常数也越大 可逆反应处于平衡状态时,正反应速率等于逆反应速率 可逆反应处于平衡状态时,各反应物和生成物的浓度相等 平衡常数与反应物初始浓度无关,而转化率的数值却随初始浓度改变
3v正(N2)= v正(H2) v正(N2)= v正(NH3) 2v正(H2)=3 v逆(NH3) v正(N2)=3 v逆(H2)
2v正(H2)=3v逆(NH3) v正(N2)=v逆(NH3) v正(N2)=3v逆(H2) v正(N2)=v正(H2)
可逆反应达到平衡时,正反应的平衡常数等于逆反应的平衡常数 可逆反应达到平衡时,正反应速率等于逆反应速率 可逆反应达到平衡时,参与反应的各物质的浓度保持不变 可逆反应达到平衡时,产物浓度幂的乘积与反应物浓度幂的乘积之比,在一定温度下是常数
各物质的量保持不变 各物质的量继续改变 V(逆=V(正),正逆反应停止 N2 、H2、NH3的速率相等
决定反应速率的主要因素是反应物的浓度 在金属钠与足量水反应中,增加水的量能加快反应速率 可逆反应达到平衡时,正、逆反应速率相等且等于零 在可逆反应中,反应物不可能完全转化为生成物
提高反应物的平衡转化率 改变平衡混合物的组成 以同样程度改变正逆反应的速率 增大正反应速率,减小逆反应速率
(g)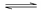 (g)+C(g),增大压强,正反应速率减小,逆反应速率增大 ⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大 A. 2 个 B. 3 个 4 个 5个
(g)+C(g),增大压强,正反应速率减小,逆反应速率增大 ⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大 A. 2 个 B. 3 个 4 个 5个
v正(N2)=v正(H2) v正(N2)=v逆(NH3) 2v正(H2)=3v逆(NH3) v正(N2)=3v逆(H2)

 2HI,当有1mol H-H键断裂的同时,有2mol H-I键生成,说明此可逆反应已达到平衡。 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,这就是该反应所达到的限度。
2HI,当有1mol H-H键断裂的同时,有2mol H-I键生成,说明此可逆反应已达到平衡。 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,这就是该反应所达到的限度。
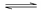 (g)+C(g),增大压强,正反应速率减小,逆反应速率增大 ⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大 A. 2 个 B. 3 个 4 个 5个
(g)+C(g),增大压强,正反应速率减小,逆反应速率增大 ⑦对达到平衡的一个放热的可逆反应,若降温,则正反应速率减小,逆反应速率增大 A. 2 个 B. 3 个 4 个 5个