你可能感兴趣的试题
1:3:2:2 2:3:3:2 1:3:2:1 3:1:2:2
前5min反应的平均速率v(NO)=0.24mol·(L·min)-1 T℃时反应①的化学平衡常数K=0.36 10min时改变反应条件可能是降低温度 若起始时向该容器中充入1.6mol NO2和4.0mol N2O4,T℃达到平衡时,NO2的物质的量浓度与图中5~10min的不同
该反应的平衡常数表达式为K.=[c(CH3OCH3)×c(H2O)]/c(CH3OH) 此时正、逆反应速率的大小:v正逆 若经10 min后反应达到平衡,此时c(CH3OH)=0.04 mol/L 0~10min内平均反应速率v(CH3OH)=1.6 mol/(L·min)
0.1 mol/(L·min) 0.3 mol/(L·min) 0.2 mol/(L·min) 0.6 mol/(L·min)
该反应的平衡常数表达式为K=/c(CH3OH) 此时正、逆反应速率的大小:v正<v逆 若经10 min后反应达到平衡,此时c(CH3OH)=0.04 mol·L-1 0~10min内平均反应速率v(CH3OH)=1.6 mol·(L·min)-1
和6mol ,发生如下反应:2A(g)+3B(g) 4C(g)+D(g)反应10min后达平衡,此时D.的浓度为0.5mol/L。下列说法正确的是( ) A.前10min反应的平均速率V.( )=0.10mol/L·min B.反应达平衡时B.的平衡浓度是1.5mol/L C.恒温下将反应容器体积缩小一半,则 的平衡浓度小于1.0mol/L D.10min后向容器中加入A.,重新平衡时A.的转化率一定大于50%
4C(g)+D(g)反应10min后达平衡,此时D.的浓度为0.5mol/L。下列说法正确的是( ) A.前10min反应的平均速率V.( )=0.10mol/L·min B.反应达平衡时B.的平衡浓度是1.5mol/L C.恒温下将反应容器体积缩小一半,则 的平衡浓度小于1.0mol/L D.10min后向容器中加入A.,重新平衡时A.的转化率一定大于50%
和2 mol 放入容积为5L.的某密闭容器中发生如下反应:A.(s)+2B(g) (g)+2D(g),经5 min后测得容器内B.的浓度减少了0.2 mol・L-1。下列叙述不正确的是 ( )A.在5 min内该反应用C.的浓度变化表示的反应速率为0.02 mol・L-1・min-1B.5 min时,容器内 的浓度为0.2 mol・L-1C.当容器内压强保持恒定时,该可逆反应达到平衡状态D.5 min时容器内气体总的物质的量为3 mol
(g)+2D(g),经5 min后测得容器内B.的浓度减少了0.2 mol・L-1。下列叙述不正确的是 ( )A.在5 min内该反应用C.的浓度变化表示的反应速率为0.02 mol・L-1・min-1B.5 min时,容器内 的浓度为0.2 mol・L-1C.当容器内压强保持恒定时,该可逆反应达到平衡状态D.5 min时容器内气体总的物质的量为3 mol
(g)+n (g)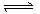 p (g)+q (g)经10 min后达到平衡,测得此时A.的浓度减少了n mol•L-1,C.的浓度增加了
p (g)+q (g)经10 min后达到平衡,测得此时A.的浓度减少了n mol•L-1,C.的浓度增加了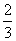 n mol•L-1,又知,平均反应速率vc=2vB 。达到平衡后,若保持温度不变,缩小容器体积,A.的转化率不变,那么该反应的化学方程式应为 A.2A(g)+6B(g)
n mol•L-1,又知,平均反应速率vc=2vB 。达到平衡后,若保持温度不变,缩小容器体积,A.的转化率不变,那么该反应的化学方程式应为 A.2A(g)+6B(g) 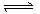 3C(g)+5D(g) B.3A(g)+B(g)
3C(g)+5D(g) B.3A(g)+B(g) 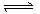 2C(g)+2D(g) C.3A(g)+B(g)
2C(g)+2D(g) C.3A(g)+B(g) 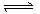 C.(g)+D(g) D.A.(g)+3B(g)
C.(g)+D(g) D.A.(g)+3B(g) 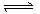 3C(g)+3D(g)
3C(g)+3D(g)
平衡向正反应方向移动了 物质A.的转化率减少了 物质B.的质量分数减少了 a>b
使反应进行完全 使达到变旋平衡 使溶液浓度变均匀 使溶解完全 使完全呈半缩醛环状结构
平衡向正反应方向移动了 物质A.的转化率减少了
物质B.的质量分数减少了 a>b
,反应到某时刻测得A. C.的物质的量浓度(mol•L﹣1)分别为:0.4,0.6,0.6,下列说法正确的是( ) A.温度升高,该反应反应速率加快,平衡常数增大 B.题目所述的某时刻正、逆反应速率的大小为V.(正)>V.(逆) 经10min反应达到平衡,则该时间内反应速率v(A.)为0.064mol/(L•min) 平衡时,再加入与起始等量的A.,达新平衡后A.的转化率增大

 4C(g)+D(g)反应10min后达平衡,此时D.的浓度为0.5mol/L。下列说法正确的是( ) A.前10min反应的平均速率V.( )=0.10mol/L·min B.反应达平衡时B.的平衡浓度是1.5mol/L C.恒温下将反应容器体积缩小一半,则 的平衡浓度小于1.0mol/L D.10min后向容器中加入A.,重新平衡时A.的转化率一定大于50%
4C(g)+D(g)反应10min后达平衡,此时D.的浓度为0.5mol/L。下列说法正确的是( ) A.前10min反应的平均速率V.( )=0.10mol/L·min B.反应达平衡时B.的平衡浓度是1.5mol/L C.恒温下将反应容器体积缩小一半,则 的平衡浓度小于1.0mol/L D.10min后向容器中加入A.,重新平衡时A.的转化率一定大于50%
 (g)+2D(g),经5 min后测得容器内B.的浓度减少了0.2 mol・L-1。下列叙述不正确的是 ( )A.在5 min内该反应用C.的浓度变化表示的反应速率为0.02 mol・L-1・min-1B.5 min时,容器内 的浓度为0.2 mol・L-1C.当容器内压强保持恒定时,该可逆反应达到平衡状态D.5 min时容器内气体总的物质的量为3 mol
(g)+2D(g),经5 min后测得容器内B.的浓度减少了0.2 mol・L-1。下列叙述不正确的是 ( )A.在5 min内该反应用C.的浓度变化表示的反应速率为0.02 mol・L-1・min-1B.5 min时,容器内 的浓度为0.2 mol・L-1C.当容器内压强保持恒定时,该可逆反应达到平衡状态D.5 min时容器内气体总的物质的量为3 mol
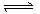 p (g)+q (g)经10 min后达到平衡,测得此时A.的浓度减少了n mol•L-1,C.的浓度增加了
p (g)+q (g)经10 min后达到平衡,测得此时A.的浓度减少了n mol•L-1,C.的浓度增加了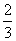 n mol•L-1,又知,平均反应速率vc=2vB 。达到平衡后,若保持温度不变,缩小容器体积,A.的转化率不变,那么该反应的化学方程式应为 A.2A(g)+6B(g)
n mol•L-1,又知,平均反应速率vc=2vB 。达到平衡后,若保持温度不变,缩小容器体积,A.的转化率不变,那么该反应的化学方程式应为 A.2A(g)+6B(g) 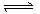 3C(g)+5D(g) B.3A(g)+B(g)
3C(g)+5D(g) B.3A(g)+B(g) 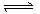 2C(g)+2D(g) C.3A(g)+B(g)
2C(g)+2D(g) C.3A(g)+B(g) 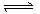 C.(g)+D(g) D.A.(g)+3B(g)
C.(g)+D(g) D.A.(g)+3B(g) 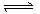 3C(g)+3D(g)
3C(g)+3D(g)