你可能感兴趣的试题
一定是共价键 一定是离子键 可能是共价键,也可能是离子键 上述说法都不正确
卤素单质从F.2到I.2,颜色加深,熔沸点升高 卤族元素从Cl到I.,最高价氧化物对应水化物的酸性减弱 卤族元素从F.到I., HX水溶液酸性增强 卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来
人体中含量最多的元素是碳元素 太阳上最丰富的元素是氢元素 海洋中含量最多的元素是氧元素 地壳中含量最多的金属元素是铝元素
卤族元素是典型的非金属元素,因此不能与其他非金属元素化合 卤族元素单质越活泼,其熔沸点就越高 卤族元素的单质都能与水剧烈反应 卤族元素的单质都能和氢气反应,且生成的气态氢化物的稳定性随单质氧化性的增强而增强
对于非空线性表,每个数据元素都有前驱 对于非空线性表,最后一个数据元素无后继 对于非空线性表,有且仅有一个开始结点 对于非空线性表,有且仅有一个终端结点
最高正价必然相等 最外层电子数不一定相等 化学性质相似 金属性自上而下增强 以上叙述没有不正确的
氢氟酸是强酸,所以具有强腐蚀性 卤族的原子半径由大到小顺序为I>Br>Cl>F 碘难溶于酒精,所以能用酒精从碘水中萃取碘 因为碘易溶于酒精,所以能用酒精从碘水中萃取碘 卤族元素的最高氧化物的水合物的酸性从氟到碘增强
在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 在金属元素区域可以寻找制备新型农药材料的元素 周期表同一主族元素性质相似
卤族元素是典型的非金属元素,因此不能与其他非金属元素反应 碱金属元素单质越活泼,其熔点和沸点就越高 卤族元素单质都能与水剧烈反应 卤族元素单质都能和氢气反应,且气态氢化物的稳定性随单质氧化性的增强而增强
离子化合物中可能存在非极性键 硫酸分子中有H.+和SO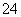 两种离子 某原子的最外层只有一个电子,它与卤族元素可能形成离子键,也可能形成共价键 离子键和共价键的实质都是电性的相互作用
两种离子 某原子的最外层只有一个电子,它与卤族元素可能形成离子键,也可能形成共价键 离子键和共价键的实质都是电性的相互作用
单质的熔点和沸点随着核电荷数的增加逐渐升高 单质的颜色随核电荷数的增加逐渐加深 单质的氧化性随核电荷数的增加逐渐减弱 氢化物的稳定性随核电荷数的增加逐渐增强
元素周期表是元素周期律的具体表现形式 在金属元素区域可以寻找制备新型农药材料的元素 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
互为同分异构体 化学性质不相同 碳、氢、氧元素的质量比相同 属于同一类有机物
卤族元素从F.到I.,HX水溶液酸性增强 卤族元素从Cl到I.,最高价氧化物对应水化物的酸性减弱 卤族元素的最低负价均为—1,最高正价均为+7 卤素单质从F2到I2,颜色加深,熔沸点升高
广义表是由零个或多个元素或子表所组成的序列 广义表的元素可以是子表,而子表的元素还可以是子表 广义表不可以是本身的子表 广义表可以被其他广义表所共享
全部卤族元素均能被Fe3+氧化 在卤族元素中,除F-外,均能被Fe3+氧化 在卤族元素中,只有Br-和I-能被Fe3+氧化 在卤族元素中,只有I-能被Fe3+氧化
卤素单质从F2到I2,颜色加深,熔沸点升高 卤族元素从Cl到I.,最高价氧化物对应水化物的酸性减弱 卤族元素从F.到I., HX水溶液酸性增强 卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质可将排在后面的卤素从它的盐溶液中置换出来
原子的最外层均有5个电子,最高价均为+5价 非金属性比同周期的氧族元素和卤族元素弱 原子半径比同周期的氧族元素、卤族元素小 稳定性:NH3 > PH3
卤素单质从F.2到I.2,颜色加深,熔沸点升高 卤族元素从Cl到I.,最高价氧化物对应水化物的酸性减弱 卤族元素从F.到I., HX水溶液酸性增强 卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质可将排在后面的卤素从它的盐溶液中置换出来
单质的熔点和沸点随核电荷数的增加逐渐升高 单质的颜色随核电荷数的增加逐渐加深 单质的氧化性随核电荷数的增加逐渐增强 氢化物的稳定性随核电荷数的增加逐渐增强

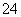 两种离子 某原子的最外层只有一个电子,它与卤族元素可能形成离子键,也可能形成共价键 离子键和共价键的实质都是电性的相互作用
两种离子 某原子的最外层只有一个电子,它与卤族元素可能形成离子键,也可能形成共价键 离子键和共价键的实质都是电性的相互作用