你可能感兴趣的试题
1是可逆反应; 2是可逆反应; 3是可逆反应; 1,2,3均不是可逆反应。
+3B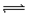 2C+2D在四种不同的情况下,反应速率分别为①VA=0.15mol/(L·S),②VB=0.6mol/(L·S),③VC=0.4mol/(L·S),④VD=0.45mol/(L·S),则以上四种情况下反应速率由大到小排列正确的是 ( ) A.②>④>③>① ②>③=④>① ④>②=③>① ④>③>②>①
2C+2D在四种不同的情况下,反应速率分别为①VA=0.15mol/(L·S),②VB=0.6mol/(L·S),③VC=0.4mol/(L·S),④VD=0.45mol/(L·S),则以上四种情况下反应速率由大到小排列正确的是 ( ) A.②>④>③>① ②>③=④>① ④>②=③>① ④>③>②>①
可逆反应,体积增大的放热反应 可逆反应,体积减小的吸热反应 可逆反应,体积增大的吸热反应
吸热可逆反应 吸热不可逆反应 放热不可逆反应 放热可逆反应
可逆反应达到平衡的重要特征是各物质的反应速率相等。 在可逆反应里,正反应的速率是正值,逆反应的速率是负值。 对于H2+I2  2HI,当有1mol H-H键断裂的同时,有2mol H-I键生成,说明此可逆反应已达到平衡。 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,这就是该反应所达到的限度。
2HI,当有1mol H-H键断裂的同时,有2mol H-I键生成,说明此可逆反应已达到平衡。 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,这就是该反应所达到的限度。
在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,叫做可逆反应。 所有的化学反应都是可逆的 有气体参加的反应或有气体生成的反应,一定要在密闭体系的条件下才能是可逆反应 可逆反应中,正反应和逆反应是相对的
放热反应和可逆反应 吸热反应和可逆反应 吸热反应和不可逆反应 放热反应和不可逆反应
在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应,叫可逆反应 所有的化学反应都是可逆的 有气体参加的反应或有气体生成的反应,一定要在密闭体系的条件下才能是可逆反应 可逆反应中,正反应和逆反应是相对的
可逆反应 总反应为不可逆反应 H2S净化度较胺法差 碱液吸收H2S的反应为不可逆反应
SO2+Br2+2H2O===H2SO4+2HBr与2HBr+H2SO4(浓) Br2+SO2↑+2H2O互为可逆反应 既能向正反应方向进行,又能向逆反应方向进行的反应叫做可逆反应 在同一条件下,同时向正、逆两个方向进行的反应叫做可逆反应 电解水生成氢气和氧气与氢气和氧气点燃生成水的反应是可逆反应
Br2+SO2↑+2H2O互为可逆反应 既能向正反应方向进行,又能向逆反应方向进行的反应叫做可逆反应 在同一条件下,同时向正、逆两个方向进行的反应叫做可逆反应 电解水生成氢气和氧气与氢气和氧气点燃生成水的反应是可逆反应
+3B 2C+2D在四种不同的情况下,反应速率分别为①VA=0.15mol/(L·S),②VB=0.6mol/(L·S),③VC=0.4mol/(L·S),④VD=0.45mol/(L·S),则以上四种情况下反应速率由大到小排列正确的是 ( ) A.②>④>③>① ②>③=④>① ④>②=③>① ④>③>②>①
2C+2D在四种不同的情况下,反应速率分别为①VA=0.15mol/(L·S),②VB=0.6mol/(L·S),③VC=0.4mol/(L·S),④VD=0.45mol/(L·S),则以上四种情况下反应速率由大到小排列正确的是 ( ) A.②>④>③>① ②>③=④>① ④>②=③>① ④>③>②>①
可逆反应正反应速率大于逆反应速率 可逆反应正反应速率小于逆反应速率 可逆反应正反应速率等于逆反应速率 逆反应速率为 0
一定温度下,在密闭容器中进行的可逆反应 一定压力下的可逆反应 一定状态下的可逆反应 一定催化剂的可逆反应
可逆反应达到平衡时,正反应的平衡常数等于逆反应的平衡常数 可逆反应达到平衡时,正反应速率等于逆反应速率 可逆反应达到平衡时,参与反应的各物质的浓度保持不变 可逆反应达到平衡时,产物浓度幂的乘积与反应物浓度幂的乘积之比,在一定温度下是常数
各物质的量保持不变 各物质的量继续改变 V(逆=V(正),正逆反应停止 N2 、H2、NH3的速率相等
1是可逆反应 2是可逆反应 3是可逆反应 1、2、3均不是可逆反应
1是可逆反应 2是可逆反应 3是可逆反应 1、2、3均不是可逆反应
(g)⇌ (g),其反应过程中能量变化如图所示,下列说法错误的是(Ea表示活化能,Ea(正)、Ea(逆)分别表示正、逆反应活化能)( ) A.该反应的△H=Ea(正)-Ea(逆) B.该反应的Ea(正)=E3-E2 只要温度升高,该可逆反应就会向逆反应方向进行 可逆反应B.(g)⇌A.(g)的△H=E2-E1

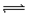 2C+2D在四种不同的情况下,反应速率分别为①VA=0.15mol/(L·S),②VB=0.6mol/(L·S),③VC=0.4mol/(L·S),④VD=0.45mol/(L·S),则以上四种情况下反应速率由大到小排列正确的是 ( ) A.②>④>③>① ②>③=④>① ④>②=③>① ④>③>②>①
2C+2D在四种不同的情况下,反应速率分别为①VA=0.15mol/(L·S),②VB=0.6mol/(L·S),③VC=0.4mol/(L·S),④VD=0.45mol/(L·S),则以上四种情况下反应速率由大到小排列正确的是 ( ) A.②>④>③>① ②>③=④>① ④>②=③>① ④>③>②>①
 2HI,当有1mol H-H键断裂的同时,有2mol H-I键生成,说明此可逆反应已达到平衡。 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,这就是该反应所达到的限度。
2HI,当有1mol H-H键断裂的同时,有2mol H-I键生成,说明此可逆反应已达到平衡。 在一定条件下,当可逆反应的正反应速率与逆反应速率相等时,反应物和生成物的浓度不再发生变化,这就是该反应所达到的限度。
 Br2+SO2↑+2H2O互为可逆反应 既能向正反应方向进行,又能向逆反应方向进行的反应叫做可逆反应 在同一条件下,同时向正、逆两个方向进行的反应叫做可逆反应 电解水生成氢气和氧气与氢气和氧气点燃生成水的反应是可逆反应
Br2+SO2↑+2H2O互为可逆反应 既能向正反应方向进行,又能向逆反应方向进行的反应叫做可逆反应 在同一条件下,同时向正、逆两个方向进行的反应叫做可逆反应 电解水生成氢气和氧气与氢气和氧气点燃生成水的反应是可逆反应
 2C+2D在四种不同的情况下,反应速率分别为①VA=0.15mol/(L·S),②VB=0.6mol/(L·S),③VC=0.4mol/(L·S),④VD=0.45mol/(L·S),则以上四种情况下反应速率由大到小排列正确的是 ( ) A.②>④>③>① ②>③=④>① ④>②=③>① ④>③>②>①
2C+2D在四种不同的情况下,反应速率分别为①VA=0.15mol/(L·S),②VB=0.6mol/(L·S),③VC=0.4mol/(L·S),④VD=0.45mol/(L·S),则以上四种情况下反应速率由大到小排列正确的是 ( ) A.②>④>③>① ②>③=④>① ④>②=③>① ④>③>②>①