你可能感兴趣的试题
pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(OH-)相等 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl-)>c(CH3COOH) 常温下物质的量浓度相等的①NH4HCO3、②NH4HSO4、③NH4Fe(SO4)2:三种溶液中NH4+的浓度:②>③>① 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数:N.前>N后
物质的量浓度相等的 和
和 混合溶液中:
混合溶液中:  常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:  常温下
常温下 相等的①
相等的① 、②
、② 、③
、③ 三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的
三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的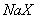 和弱酸
和弱酸 混合后呈酸性的溶液中:
混合后呈酸性的溶液中: 
含 溶质的任何溶液,物质的量浓度一定相等。 用
溶质的任何溶液,物质的量浓度一定相等。 用 配制
配制 ,若称量 操作如图所示,最终配制溶液的浓度偏高
,若称量 操作如图所示,最终配制溶液的浓度偏高
体积相同、物质的量浓度相同的同种溶液所含溶质的粒子数一定相同。
在 溶液中,含有的氧原子的物质的量是
溶液中,含有的氧原子的物质的量是 。
。
c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4C.1溶液中,溶质物质的量浓度大小关系是: 已知25℃时Ksp(AgCl)=1.8×10-10,则在0.1 mol·L.-lA.1Cl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10 mol·L.-l 25℃时0.2 mol·L.-l HC1溶液与等体积0.05 mol·L.-l Ba(OH)2溶液混合后,溶液的pH约为1 0.1mol·L.-l NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(A2-)>c(H2A.)
已知25℃时Ksp(AgCl)=1.8×10-10,则在0.1 mol·L.-lA.1Cl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10 mol·L.-l 25℃时0.2 mol·L.-l HC1溶液与等体积0.05 mol·L.-l Ba(OH)2溶液混合后,溶液的pH约为1 0.1mol·L.-l NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(A2-)>c(H2A.)
配制一定物质的量浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏高
用托盘天平称取25.20g NaCl
用100mL量筒量取5.2mL盐酸
用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏高
酸性:HCN>HClO pH:HClO<HCN 浓度:c(CN-)<c(ClO-) 与NaOH恰好完全反应时,消耗NaOH的物质的量:HClO>HCN
粒子(H2A.HA-、A2-)的物质的量分数随pH变化的关系如图所示,下列说法正确的是( ) A.H2A的电离方程式:H2A H.++HA- pH=5时,在NaHA和Na2A的混合溶液中:c(HA-)∶c(A2-)=1∶100 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为 c(Na+)>c(HA-)>c(A2-) Na2A溶液中必存在c(OH-)=c(H+)+c(HA-)+2c(H2A.),各粒子浓度均大于0
H.++HA- pH=5时,在NaHA和Na2A的混合溶液中:c(HA-)∶c(A2-)=1∶100 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为 c(Na+)>c(HA-)>c(A2-) Na2A溶液中必存在c(OH-)=c(H+)+c(HA-)+2c(H2A.),各粒子浓度均大于0
一定体积的溶液里所含溶剂的物质的量来表示溶液的浓度,就是溶液的物质的量浓度 一定体积的溶液里所含溶质的物质的量来表示的浓度,就是溶液的物质的量浓度 配置500mL的0.5mol/L的氢氧化钠溶液,需要固体氢氧化钠10g 配置500mL的0.5mol/L的氢氧化钠溶液,需要固体氢氧化钠20g
常温下,将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合溶液中:c(Na+)=c(CH3COO-) 相同条件下pH=5的①NH4Cl溶液 ②CH3COOH溶液 ③稀盐酸溶液中由水电离的 c(H+):①>②>③ pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序:①=②>③ 0.1mol/L醋酸钡溶液中,c (Ba2+)>c(CH3COO-)>c(OH-)> c (H+)
pH = 2 的HA溶液与pH=12的MOH溶液任意比混合 c(H+) + c(M+)=c(A-) + c(OH-) pH相等的CH3COONa、NaOH和NaCO3三种溶液: c(NaOH) < c(CH3COONa) < c(NaCO3) 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合 c(CH3COO-) + 2c(OH-) = 2c(H+) + c(CH3COOH) 0.1mol·L-1的NaHA溶液,其pH = 4:c(HA-)>c(H+)>c(H2A.)>c(A2-)
等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(OH-)>c(H+) 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7: c(Na+)>c(CH3COOH)=c(Cl-) 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中: c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) pH=1的NaHSO4溶液:c(H+)=2c(SO42-)+c(OH-)
pH=2的HA溶液与pH=12的MOH溶液任意比混合: c(H+) + c(M+) === c(OH-) + c(A-) pH相等的CH3COONa、NaOH和Na2CO3三种溶液: c(NaOH)<c(CH3CO ONa)<c(Na2CO3) 物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合: c(CH3COO-) +2c(OH-) === c(H+) + c(CH3COOH) 0.1mol•L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
c(M+)>c(OH-)>c(A-)>c(H+) c(M+)>c(A-)>c(H+)>c(OH-) c(M+)>c(A-)>c(OH-)>c(H+) c(M+)+c(H+)>c(A-)+c(OH-)
酸式盐的溶液一定显酸性 只要酸与碱的物质的量浓度和体积分别相同,它们反应后的溶液就呈中性 纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等 碳酸溶液中氢离子物质的量浓度是碳酸根离子物质的量浓度的二倍
常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:
c(Na+)>c(Cl-)> c(CH3COOH)
等物质的量浓度等体积的硫化钠溶液与硫酸氢钾溶液混合
C(Na+)> (K+)>C.(SO42-)>C.(HS-)>C.(OH-)>C(H+)
C.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb
pH <7的某二元弱酸的酸式盐NaHA溶液中有c(H+)+2 c(A2-)==c(OH-) +c (H2A.)
配制一定物质的量浓度的溶液时,定容时仰视刻度线会导致所配溶液浓度偏高 用托盘天平称取25.20 g NaCl 用100 mL的量筒量取5.2 mL的盐酸 用浓盐酸配制一定物质的量浓度的稀盐酸,量取浓盐酸时仰视量筒的刻度线会导致所配溶液浓度偏高
NaHSO3和NaHCO3的中性混合溶液中(S.和C.均用R.表示):c(Na+)=c(HRO3-)+2c(RO32-) 常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:c(Na+)>c(Cl―)>c(CH3COOH) 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):①<③<② 等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少:N.前后

 和
和 混合溶液中:
混合溶液中:  常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:
常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后溶液中:  常温下
常温下 相等的①
相等的① 、②
、② 、③
、③ 三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的
三种溶液中,溶质的物质的量浓度大小:①>②>③ 等体积、等物质的量浓度的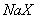 和弱酸
和弱酸 混合后呈酸性的溶液中:
混合后呈酸性的溶液中: 
 溶质的任何溶液,物质的量浓度一定相等。 用
溶质的任何溶液,物质的量浓度一定相等。 用 配制
配制 ,若称量 操作如图所示,最终配制溶液的浓度偏高
,若称量 操作如图所示,最终配制溶液的浓度偏高 溶液中,含有的氧原子的物质的量是
溶液中,含有的氧原子的物质的量是 。
。
 已知25℃时Ksp(AgCl)=1.8×10-10,则在0.1 mol·L.-lA.1Cl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10 mol·L.-l 25℃时0.2 mol·L.-l HC1溶液与等体积0.05 mol·L.-l Ba(OH)2溶液混合后,溶液的pH约为1 0.1mol·L.-l NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(A2-)>c(H2A.)
已知25℃时Ksp(AgCl)=1.8×10-10,则在0.1 mol·L.-lA.1Cl3溶液中,Ag+的物质的量浓度最大可达到6.0×10-10 mol·L.-l 25℃时0.2 mol·L.-l HC1溶液与等体积0.05 mol·L.-l Ba(OH)2溶液混合后,溶液的pH约为1 0.1mol·L.-l NaHA溶液的pH=4,则有c(HA-)>c(H+)>c(A2-)>c(H2A.)
 H.++HA- pH=5时,在NaHA和Na2A的混合溶液中:c(HA-)∶c(A2-)=1∶100 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为 c(Na+)>c(HA-)>c(A2-) Na2A溶液中必存在c(OH-)=c(H+)+c(HA-)+2c(H2A.),各粒子浓度均大于0
H.++HA- pH=5时,在NaHA和Na2A的混合溶液中:c(HA-)∶c(A2-)=1∶100 等物质的量浓度的NaHA和Na2A溶液等体积混合,离子浓度大小关系为 c(Na+)>c(HA-)>c(A2-) Na2A溶液中必存在c(OH-)=c(H+)+c(HA-)+2c(H2A.),各粒子浓度均大于0