你可能感兴趣的试题
这是电解NaOH溶液的装置 该装置中Pt为正极,电极反应为O2+2H2O+4e-==4OH- 该装置中Fe为负极,电极反应为Fe+2OH-===Fe(OH)2+2e- 这是一个原电池装置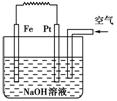
原电池是把电能转化为化学能的装置 形成原电池后,原电池中的阳离子移向正极 原电池中电子流出的一极是正极 原电池的两极发生的反应均为氧化还原反应
Al、Cu、稀H2SO4组成原电池,负极反应式为:Al-3eˉ=Al3+ Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3eˉ+4OHˉ=AlO2ˉ+2H2O 由Al、Cu、浓硝酸组成原电池,负极反应式为:Cu-2eˉ=Cu2+ 由Fe、Cu、FeCl3溶液组成原电池,负极反应式:Cu-2eˉ=Cu2+
该装置能形成原电池,其中铝是负极 该装置能形成原电池,其中铜是负极 该装置不能形成原电池 以上说法均不正确
当V正=V逆=0时,体系即达到平衡 VNO=VNO2时,体系即达到平衡 当体系中[NO]:[O2]:[NO2]=2:1:2时,体系即达到平衡 在加压时,正反应速度增大,逆反应速度减小,因此平衡向有利于生成NO2的方向移动
原电池是把电能思化为化学能的装置 原电池中电子流出的一极是正极,发生氧化反应 原电池的两极发生的反应均为氧化还原反应 形成原电池,原电池中的阳离子向正极移动
原电池负极被氧化 任何化学反应都能设计成原电池 在原电池内部阳离子向正极区域移动 原电池是把化学能转化为电能的装置
Al为电池的负极,电极反应式为Al-3e-+4OH-===AlO +2H2O 原电池工作过程中,电解质溶液的pH减小 原电池工作一段时间,两极的质量均减小 原电池工作过程中,AlO
+2H2O 原电池工作过程中,电解质溶液的pH减小 原电池工作一段时间,两极的质量均减小 原电池工作过程中,AlO 移向AgO/Ag电极
移向AgO/Ag电极
这是电解NaOH溶液的装置 该装置中Pt为正极,电极反应为O2+2H2O+4e-―→4OH- 该装置中Fe为负极,电极反应为Fe+2OH-―→Fe(OH)2+2e- 这是一个原电池装置
此装置能将化学能转变为电能 石墨电极的反应式:O2+2H2O+4e—=4OH— 电子由Cu电极经导线流向石墨电极 电池总的反应是:2Cu+O2+4HCl=2CuCl2+2H2O
锌电极上发生氧化反应做还原剂被氧化 电子流动方向由Zn经外电路到Cu SO42- 向Cu极移动 原电池工作一段时间后溶液的c(H+)减小
该装置能形成原电池,其中铝是负极 该装置能形成原电池,其中铜是负极 该装置不能形成原电池 以上说法均不正确
这是电解NaOH溶液的装置 该装置中Pt为正极,电极反应为O2+2H2O+4e-==4OH- 该装置中Fe为负极,电极反应为Fe+2OH-===Fe(OH)2+2e- 这是一个原电池装置
原电池是利用化学反应产生电流的装置 原电池可以把化学能转变为电能 原电池的负极发生氧化反应 原电池的正极是流出电子的一极
原电池的正极反应为:O2 + 2H2O + 4e-→4OH- 原电池的负极反应为:Fe→Fe3++3e- 钢铁设备上连接铜块可以防止腐蚀 钢铁与外加直流电源的正极相连可以防止腐蚀
原电池是将化学能转化为电能的装置 在原电池中,电子流出的一极是负极,发生氧化反应 锌、铜、硫酸组成的原电池中,溶液中的 Zn2+、 H+均向正极移动 构成原电池的两个电极必须是活泼性不同的两种金属
b电极是正极 a电极的电极反应为: O2 +2 H2O+ 4e- = 4OH- 氢氧燃料电池中的电子是从a电极经外电路流向b电极 氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置 
燃料电池的优点是能量转化率很高,反应物不必全部储藏在电池内 电解质为KOH,氢气和氧气构成的燃料电池在放电过程中KOH溶液的浓度不变 电池充电时,原电池的正极变成了电解池的阳极 钢铁发生吸氧腐蚀时,正极反应为O2+4e-+2H2O===4OH-
“双吸剂”中的生石灰有吸水作用 “双吸剂”吸收氧气时,发生了原电池反应 吸收氧气的过程中,铁作原电池的负极 炭粉上发生的反应为:O2 + 4e-+ 4H+====2H2O
该装置中Pt为正极,电极反应为O2+2H2O+4e-=4OH- 该装置中Fe为负极,电极反应为Fe+2OH--2e-=Fe(OH)2 这是电解NaOH溶液的装置 这是一个原电池装置 


 +2H2O 原电池工作过程中,电解质溶液的pH减小 原电池工作一段时间,两极的质量均减小 原电池工作过程中,AlO
+2H2O 原电池工作过程中,电解质溶液的pH减小 原电池工作一段时间,两极的质量均减小 原电池工作过程中,AlO 移向AgO/Ag电极
移向AgO/Ag电极



