你可能感兴趣的试题
MnO2作催化剂加入H2O2中,发生催化反应,产生H2O和O2 100Kpa条件下,将CaCo3加热到900℃,分解生成CaO和CO2 H2O在通电的情况下产生H2和O2 植物在光照条件下发生光合作用
正反应吸热 加入催化剂,该化学反应的反应热不变 加入催化剂后,该反应的能量随反应历程的变化示意图可用图乙表示 加入催化剂可增大正反应速率,降低逆反应速率
反应的速率与I.-的浓度有关 IO-也是该反应的催化剂
反应活化能等于98 KJ•mol-1 v(H2O2)=v(H2O)=v(O2)
降低温度,SO3的分解速率加快 加入催化剂,可提高SO3的平衡转化率 加入催化剂,减小了反应的活化能,活化分子百分数提高 反应物的总能量大于生成物的总能量
加入催化剂,减小了反应的活化能 加人催化剂,可提高SO3的平衡转化率 降低温度,SO3的分解速率加快 反应物的总能量大于生成物的总能量
若降低温度,可以加快反应速率 使用催化剂是为了加快反应速率 在上述条件下,SO2能完全转化为SO3 达到平衡时,SO2和SO3的浓度一定相等
H2O2分解属于吸热反应 加入催化剂,减小了反应的热效应 加入催化剂,可提高正反应的活化能 反应物的总能量高于生成物的总能量
0.2mol HI充分分解,吸收1.25kJ热量 加入催化剂,Ea减小,△H.不变 其他条件不变,升高温度,反应速率加快,HI分解率不变 其他条件不变,增大压强,反应速率加快,HI分解率增大 
该反应是吸热反应 加入催化剂,H2O2分解产生的O2量增多 H2O2分解的热化学方程式:2H2O2  2H2O+O2↑ H.<0 加入催化剂,降低了反应的活化能
2H2O+O2↑ H.<0 加入催化剂,降低了反应的活化能
加入催化剂,减小了反应的热效应 加入催化剂,可提高H2O2的平衡转化率 H2O2分解的热化学方程式:H2O2===H2O+1/2 O2 ΔH.>0 反应物的总能量高于生成物的总能量
加入催化剂,减小了反应的活化能 加入催化剂,可提高HI的平衡转化率 降低温度,HI的分解速率加快 反应物的总能量大于生成物的总能量
若降低温度,可以加快反应速率 使用催化剂是为了加快反应速率 在上述条件下,SO2能完全转化为SO3 达到平衡时,SO2和SO3的浓度一定相等
反应物的总能量高于生成物的总能量 加入催化剂,可提高H2O2的平衡转化率 H2O2分解的热化学方程式:H2O2=H2O+1/2O2 △H>0 加入催化剂,减小了反应的热效应
加入催化剂,减小了反应的热效应 加入催化剂,可提高H2O2的平衡转化率 H2O2分解的热化学方程式:2H2O2 = 2H2O + O2 ΔH>0 反应物的总能量高于生成物的总能量
0.2mol HI充分分解,吸收1.25kJ热量 加入催化剂,Ea减小,△H.不变 其他条件不变,升高温度,反应速率加快,HI分解率不变 其他条件不变,增大压强,反应速率加快,HI分解率增大 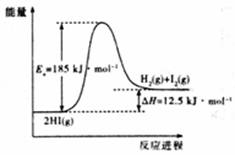
加入催化剂,减小了反应的热效应 加入催化剂,可提高H2O2的平衡转化率 H2O2分解的热效应△H<0 反应物的总能量高于生成物的总能量
加入催化剂,减小了反应的热效应 加入催化剂,可提高H2O2的平衡转化率 H2O2分解的热化学方程式:H2O2→ H2O+O2+Q. 反应物的总能量高于生成物的总能量
若降低温度,可以加快反应速率 使用催化剂是为了加快反应速率 在上述条件下,SO2能完全转化为SO3 达到平衡时,SO2和SO3的浓度一定相等


 2H2O+O2↑ H.<0 加入催化剂,降低了反应的活化能
2H2O+O2↑ H.<0 加入催化剂,降低了反应的活化能
