你可能感兴趣的试题
溶液的pH 醋酸的电离平衡常数 溶液的导电能力 醋酸的电离程度
反应达到平衡时,X.的转化率为60% 反应可表示为X+3Y 2Z,其平衡常数为1600 增大压强使平衡向生成Z.的方向移动,平衡常数增大 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 增大压强使平衡向生成Z.的方向移动,平衡常数增大 改变温度可以改变此反应的平衡常数
电离平衡常数越小,表示弱电解质的电离能力越弱 电离平衡常数与温度无关 不同浓度的同一弱电解质,其电离平衡常数不同 多元弱酸各步电离平衡常数相互关系为:K1〈K2〈K3
在18℃时溶解度比25℃时小 的电离是一个吸热过程 温度高时电离度变小 温度高时溶液中的氢离子浓度变小
不同浓度的同一弱电解质,其电离平衡常数(K.)不同 电离平衡常数(K.)越小,表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K.1<K.2<K.3 CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小
在18℃时溶解度比25℃时小 的电离是一个放热过程 温度高时电离度变大 温度低时溶液中的氢氧根离子浓度变大
在18℃时溶解度比25℃时小 的电离是一个放热过程 温度高时电离度变大 温度低时溶液中的氢离子浓度变大
反应达平衡时,X.的转化率为50% 反应可表示为:X.+3Y 2Z,其平衡常数为1600 增大压强使平衡向生成Z.的方向移动,平衡常数增大 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 增大压强使平衡向生成Z.的方向移动,平衡常数增大 改变温度可以改变此反应的平衡常数
在18℃时溶解度比25℃时小 电离是一个放热过程 温度高时电离度变大 温度低时溶液中的氢离子浓度变大
电离平衡常数(K.)与温度无关 H2CO3的电离常数表达式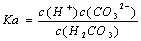 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
溶液的pH 醋酸的电离平衡常数 溶液的导电能力 醋酸的电离程度
在18℃时溶解度比25℃时小 的电离是一个吸热过程 温度高时电离度变小 温度高时溶液中的氢氧根离子浓度变小
在18℃时溶解度比25℃时小 的电离是一个吸热过程 温度高时电离度变大 温度高时溶液中的氢离子浓度变小
在18℃时溶解度比25℃时小 的电离是一个吸热过程 温度高时电离度变大 温度越低时溶液中的氢氧根离子浓度变得越大
反应达到平衡时,X.的转化率为50% 反应可表示为X+3Y 2Z,其平衡常数为1600 增大压强使平衡向生成Z.的方向移动,平衡常数增大 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 增大压强使平衡向生成Z.的方向移动,平衡常数增大 改变温度可以改变此反应的平衡常数
在18℃时溶解度比25℃小 的电离过程是放热过程 温度高时电离度变大 温度低时溶液中的氢离子浓度变大
电离度越大,电离平衡常数越大; 浓度越稀,电离度越大,电离平衡常数越大; 在相同的温度下电离度可变,而电离平衡常数不变; 多元弱酸的每一步电离平衡常数是相同的


 2Z,其平衡常数为1600 增大压强使平衡向生成Z.的方向移动,平衡常数增大 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 增大压强使平衡向生成Z.的方向移动,平衡常数增大 改变温度可以改变此反应的平衡常数
 2Z,其平衡常数为1600 增大压强使平衡向生成Z.的方向移动,平衡常数增大 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 增大压强使平衡向生成Z.的方向移动,平衡常数增大 改变温度可以改变此反应的平衡常数
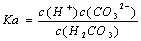 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1 2Z,其平衡常数为1600 增大压强使平衡向生成Z.的方向移动,平衡常数增大 改变温度可以改变此反应的平衡常数
2Z,其平衡常数为1600 增大压强使平衡向生成Z.的方向移动,平衡常数增大 改变温度可以改变此反应的平衡常数