你可能感兴趣的试题
平衡向右移动 平衡向左移动 加入催化剂能改变化学反应速度 化学反应速度增加
2、6、3、5 3、1、2、2 3、1、2、1 1、3、2、2
K越大,达到平衡时,反应进行的程度越小 K越小,达到平衡时,反应物的转化率越大 K随反应物浓度改变而改变 K随温度改变而改变
K.值越大,表明该反应速率越快,反应物的转化率也越大 若缩小反应器的容积,能使平衡正向移动,则K.增大 温度相同,K.值也一定相同。 pC(g)  mA(g)+nB(g) 的平衡常数与K.互为相反数。
mA(g)+nB(g) 的平衡常数与K.互为相反数。
正反应吸热:m+n>p+q 正反应放热:m+n正反应放热:m+n>p+q 正反应吸热:m+n |
|  |
平衡常数发生变化,化学平衡必发生移动 化学平衡发生移动,平衡常数必发生变化 反应物的转化率越大,达到平衡时,K.值越大 温度越高,达到平衡时,K.值越大
的转化率与压强、温度T.的关系。分析图中曲线可以得出的结论是( ) 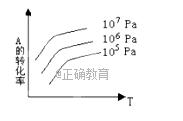 A.正反应吸热,m+n >p+q 正反应吸热,m+n 正反应放热,m+n >p+q 正反应放热,m+n
A.正反应吸热,m+n >p+q 正反应吸热,m+n 正反应放热,m+n >p+q 正反应放热,m+n
K越大,达到平衡时,反应进行的程度越小 K越小,达到平衡时,反应物的转化率越大 K随反应物浓度改变而改变 K随温度改变而改变
的转化率与压强、温度T.的关系。分析图中曲线可以得出的结论是A.正反应吸热,m+n >p+q 正反应吸热,m+n 正反应放热,m+n >p+q 正反应放热,m+n
降温,化学平衡向正反应方向移动 使用催化剂可使D.%有所增加 化学方程式中气体的化学计量数m+n>q B.的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 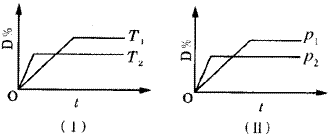
的转化率与压强、温度的关系,分析可以得出的正确结论是( ) A.正反应是吸热反应;且m+n>p+q 正反应是吸热反应;且m+n正反应是放热反应;且m+n>p+q 正反应是放热反应;且m+n
降温,化学平衡向正反应方向移动
使用催化剂可使D.%有所增加
化学方程式中气体的化学计量数m<p+q
B.的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动。
K越大,达到平衡时,反应进行的程度越小 K越小,达到平衡时,反应物的转化率越大 K随反应物浓度改变而改变 K随温度改变而改变
的转 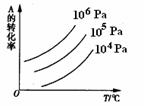 化率与压强、温度的关系。下列叙述正确的是( ) A.正反应是放热反应;m+n>p+q 正反应是吸热反应;m+n<P+q 正反应是放热反应;m+n<p+q 正反应是吸热反应;m+n>p+q
化率与压强、温度的关系。下列叙述正确的是( ) A.正反应是放热反应;m+n>p+q 正反应是吸热反应;m+n<P+q 正反应是放热反应;m+n<p+q 正反应是吸热反应;m+n>p+q
2、6、3、5 3、1、2、2 3、1、2、1 1、3、2、2
K.越大,达到平衡时,反应进行的程度越大 K.越小,达到平衡时,反应物的转化率越大 K.随反应物浓度的改变而改变 K.随温度和压强的改变而改变
2、6、3、5 3、1、2、2 3、1、2、1 1、3、2、2
增加A.的量,平衡正向移动,达到新平衡时K.值增大 升高温度,K.值增大 K.越大,说明该反应的进行程度越大,转化率越高 该反应的K.=
正反应吸热,m+n>p+q 正反应吸热,m+n<p+q
正反应放热,m+n>p+q 正反应放热,m+n<p+q

 mA(g)+nB(g) 的平衡常数与K.互为相反数。
mA(g)+nB(g) 的平衡常数与K.互为相反数。

 A.正反应吸热,m+n >p+q 正反应吸热,m+n
A.正反应吸热,m+n >p+q 正反应吸热,m+n 
 化率与压强、温度的关系。下列叙述正确的是( ) A.正反应是放热反应;m+n>p+q 正反应是吸热反应;m+n<P+q 正反应是放热反应;m+n<p+q 正反应是吸热反应;m+n>p+q
化率与压强、温度的关系。下列叙述正确的是( ) A.正反应是放热反应;m+n>p+q 正反应是吸热反应;m+n<P+q 正反应是放热反应;m+n<p+q 正反应是吸热反应;m+n>p+q
