你可能感兴趣的试题
S(s)+O2(g)=SO2(g);△H.=―297.23kJ・mol-1 2H2 (g)+ O2 (g) =2H2O(1);△H.=―571.6 kJ CaCO3(s)= CaO(s) +CO2 (g) ;△H. =178.5 kJ・mol Zn +CuSO4 (aq)=ZnSO4 (aq) +Cu ; △H. =―216kJ・mol-1
Zn(s) + H2SO4(aq) = ZnSO4(aq) + H2↑(g) ΔH<0 2CO(g)+ O2(g) =2CO2(g) ΔH<0 C.(s) + CO2(g) = 2 CO(g) ΔH>0 H.+(aq)+ OH-(aq)= H2O (l) ΔH>0
1 molZn的能量高于1 molH2的能量 反应物Zn和H2SO4的总能量高于产物 ZnSO4和H2的总能量 如果Zn足量,反应速率会经历由慢到快到慢的过程 用锌粉代替锌粒,速率会加快
、ZnSO4、H2SO4 FeSO4、H2SO4 ZnSO4、CuSO4 ZnSO4、FeSO4
Zn和H2SO4的总能量大于ZnSO4和H2的总能量 反应过程中能量关系可用上图表示 若将该反应设计成原电池,则Zn为负极 若将该反应设计成原电池,当有32.5g锌溶解时, 正极放出11.2L.气体
Zn和H2SO4的总能量大于ZnSO4和H2的总能量 反应过程中能量关系可用右图表示 若将该反应设计成原电池,则Zn为负极 若将该反应设计成原电池,当有32.5g锌溶解时,正极放出11.2L.气体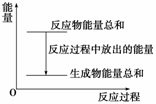
Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1 Ba2+(aq)+SO
(aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1 Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-18 kJ·mol-1 Ba2+(aq)+SO
(aq)===BaSO4(s) ΔH=-18 kJ·mol-1 Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-73 kJ·mol-1 Ba2+(aq)+SO
(aq)===BaSO4(s) ΔH=-73 kJ·mol-1 Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-0.72 kJ·mol-1
(aq)===BaSO4(s) ΔH=-0.72 kJ·mol-1
该反应的△H.值与反应物用量无关 该反应的化学能可以转化为电能 反应物的总能量高于生成物的总能量 该反应中反应物的化学键断裂放出能量,生成物化学键形成吸收能量
Zn和H2SO4的总能量大于ZnSO4和H2的总能量 反应过程中能量关系可用上图表示 若将该反应设计成原电池,则Zn为负极 若将该反应设计成原电池,当有32.5 g锌溶解时正极放出11.2L.气体
该反应中旧键断裂所吸收的能量大于新键形成所放出的能量 该反应放出热量的多少与反应物的用量有关 该反应的化学能可以转化为电能 反应物的总能量高于生成物的总能量
该反应的ΔH值与反应物用量无关 该反应的化学能可以转化为电能 反应物的总能量高于生成物的总能量 该反应中反应物的化学键断裂放出能量小于生成物化学键形成吸收能量
Zn和H2SO4的总能量大于ZnSO4和H2的总能量 反应过程中能量关系可用上图表示 若将该反应设计成原电池,则Zn为负极 若将该反应设计成原电池,当有32.5g锌溶解时, 正极放出11.2L.气体
NaOH(aq)+1/2H2SO4(aq) 1/2Na2SO4(aq)+H2O(L.);△H=-11.46kJ/mol NaOH(aq)+1/2H2SO4(aq) 1/2Na2SO4(aq)+H2O(L.);△H=-57.3kJ/mol 2NaOH(aq)+H2SO4(aq) Na2SO4(aq)+2H2O(L.); △H=+114.6kJ/mol NaOH(aq)+1/2H2SO4(aq) 1/2Na2SO4(aq)+H2O(L.);△H=+114.6kJ/mol
该反应中旧键断裂需吸收能量,新键形成需放出能量,所以总能量不变 上述热化学方程式中的ΔH.的值与反应物的用量无关 该反应的化学能可以转化为电能 反应物的总能量高于生成物的总能量
HCl(aq)+ NaOH(aq)=== NaCl(aq)+ H2O(l) △H < 0 2CH3OH(l)+3O2(g)=== 2CO2(g)+ 4H2O(l) △H < 0 Zn(s)+CuSO4(aq)=== ZnSO4(aq)+Cu(s) △H < 0 2H2(g)+ O2(g)=== 2H2O(l) △H < 0
Zn和H2SO4的总能量大于ZnSO4和H2的总能量 反应过程中能量关系可用上图表示 若将该反应设计成原电池,则Zn为负极 若将该反应设计成原电池,当有32.5g锌溶解时正极放出11.2L.气体
Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1 Ba2+(aq)+SO
(aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1 Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-18 kJ·mol-1 Ba2+(aq)+SO
(aq)===BaSO4(s) ΔH=-18 kJ·mol-1 Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-73 kJ·mol-1 Ba2+(aq)+SO
(aq)===BaSO4(s) ΔH=-73 kJ·mol-1 Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-0.72 kJ·mol-
(aq)===BaSO4(s) ΔH=-0.72 kJ·mol-



 (aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1 Ba2+(aq)+SO
(aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1 Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-18 kJ·mol-1 Ba2+(aq)+SO
(aq)===BaSO4(s) ΔH=-18 kJ·mol-1 Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-73 kJ·mol-1 Ba2+(aq)+SO
(aq)===BaSO4(s) ΔH=-73 kJ·mol-1 Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-0.72 kJ·mol-1
(aq)===BaSO4(s) ΔH=-0.72 kJ·mol-1
 (aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1 Ba2+(aq)+SO
(aq)===BaSO4(s) ΔH=-2.92 kJ·mol-1 Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-18 kJ·mol-1 Ba2+(aq)+SO
(aq)===BaSO4(s) ΔH=-18 kJ·mol-1 Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-73 kJ·mol-1 Ba2+(aq)+SO
(aq)===BaSO4(s) ΔH=-73 kJ·mol-1 Ba2+(aq)+SO (aq)===BaSO4(s) ΔH=-0.72 kJ·mol-
(aq)===BaSO4(s) ΔH=-0.72 kJ·mol-