你可能感兴趣的试题
还原剂是CN-,氧化产物只有N2 氧化剂是ClO-,还原产物是HCO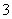 配平后氧化剂与还原剂的计量数之比为5∶2 标准状况下若生成2.24L. N2,则转移电子0.5 mol
配平后氧化剂与还原剂的计量数之比为5∶2 标准状况下若生成2.24L. N2,则转移电子0.5 mol
a等于10 该化学反应为复分解反应 丙一定为催化剂 b等于12
该容器中发生了氧化还原反应 该反应中HNO3、H2O等物质是反应物,H2SO4、NO、H3AsO4是生成物 HNO3、H2SO4、H3AsO4都属于最高价氧化物的水化物 该反应中只有砷元素被氧化、只有氮元素被还原
化学反应过程中,一定有化学键的断裂和形成 化学反应过程中,某离子被沉淀完全时,该离子在溶液中的浓度即为0 化学反应过程中,分子的种类和数目一定发生改变 放热反应的反应速率,一定比吸热反应的反应速率快
还原剂是含CN-的物质,氧化产物不只有N.2 氧化剂是ClO-,还原产物是HCO3- 配平后氧化剂与还原剂的化学计量数之比为5:2 若生成2.24LN2则转移电子1mol
B.C.D.四种物质。在一定条件下充分反应(其中只发生一个化学反应),测得反应前后各物质的质量如下表表示: 试判断该密闭容器中发生反应的化学反应基本类型为( )A.化合反应 分解反应 置换反应 无法判断
增加Fe2O3的量 保持容器体积不变,增加H2输入量 减少Fe的量 保持容器体积不变,增加H2O(g)
氯气通入氯化亚铁溶液中:Fe2++Cl2== 2Cl-+Fe3+ 氯气与水反应:Cl2 + H2O== Cl-+ ClO- + 2H+ 铜与稀硝酸反应:3Cu + 8H+ + 2NO == 3Cu2+ + 2NO↑ + 4H2O 三氯化铝中加入过量的氨水:Al3++4 NH3·H2O = AlO2— +4 NH4+ + 2 H2O
== 3Cu2+ + 2NO↑ + 4H2O 三氯化铝中加入过量的氨水:Al3++4 NH3·H2O = AlO2— +4 NH4+ + 2 H2O
配平后氧化剂与还原剂的化学计量数之比为5:2 氧化剂是ClO-,还原产物是HCO3-
还原剂是含CN-的物质,氧化产物只有N2
若生成2.24LN2(标准状况).则转移电子0.5mol
t2时改变的条件可能是升高了温度或增大了压强 平衡后若加入少量炭,平衡向逆反应方向移动 平衡后若加入氢气,上述反应的ΔH会增大 起始时刻和达平衡后容器的压强之比为5∶6 
氯气通入氯化亚铁溶液中:Fe2++Cl2== 2Cl-+Fe3+ 氯气与水反应:Cl2 + H2O== Cl-+ ClO- + 2H+ 铜与稀硝酸反应:3Cu + 8H+ + 2NO == 3Cu2+ + 2NO↑ + 4H2O 三氯化铝中加入过量的氨水:Al3++4 NH3·H2O = AlO2— +4 NH4+ + 2 H2O
== 3Cu2+ + 2NO↑ + 4H2O 三氯化铝中加入过量的氨水:Al3++4 NH3·H2O = AlO2— +4 NH4+ + 2 H2O
该反应为吸热反应 容器Ⅲ达到平衡时,再充入少量氦气,平衡将向正反应方向移动 容器Ⅱ达到平衡时,容器中COS的物质的量浓度为0.025 mol • L-1 607K.时,该反应的平衡常数为0.50
Cu与HNO3溶液 CO2与NaOH溶液 Zn与H2SO4溶液 Fe2O3与HCl溶液

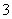 配平后氧化剂与还原剂的计量数之比为5∶2 标准状况下若生成2.24L. N2,则转移电子0.5 mol
配平后氧化剂与还原剂的计量数之比为5∶2 标准状况下若生成2.24L. N2,则转移电子0.5 mol
 == 3Cu2+ + 2NO↑ + 4H2O 三氯化铝中加入过量的氨水:Al3++4 NH3·H2O = AlO2— +4 NH4+ + 2 H2O
== 3Cu2+ + 2NO↑ + 4H2O 三氯化铝中加入过量的氨水:Al3++4 NH3·H2O = AlO2— +4 NH4+ + 2 H2O

 == 3Cu2+ + 2NO↑ + 4H2O 三氯化铝中加入过量的氨水:Al3++4 NH3·H2O = AlO2— +4 NH4+ + 2 H2O
== 3Cu2+ + 2NO↑ + 4H2O 三氯化铝中加入过量的氨水:Al3++4 NH3·H2O = AlO2— +4 NH4+ + 2 H2O