你可能感兴趣的试题
2 mol NH3 0.5 mol NH3 0.9 mol N2 H2和NH3物质的量相等
甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-38.6 kJ·mol-1 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1 25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为:H2SO4(aq)+2KOH(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1 25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为:H2SO4(aq)+2KOH(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
加入催化剂,不能改变该化学反应的反应热 b曲线是加入催化剂时的能量变化曲线 该反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ/mol 在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ
2NH3(g) ΔH=-92 kJ/mol 在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ
CO、H2、CH4; CO、H2、N2; CO、CO2、N2; CO2、H2、N2。
v(H2)=v(N2)= v(NH3) v(H2)=3 v(N2) v(N2)=2 v(NH3) v(NH3)=3/2v(H2)
该反应的热化学方程式为: N2 + 3H2  2NH3, △H = -92kJ·mol-1 a曲线是加入催化剂时的能量变化曲线 加入催化剂, 该化学反应的反应热改变 在温度、体积一定的条件下, 通入lmol N2和3molH.2 反应后放出的 热量为Q1kJ, 若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ 则184>Q2 >2Q1
2NH3, △H = -92kJ·mol-1 a曲线是加入催化剂时的能量变化曲线 加入催化剂, 该化学反应的反应热改变 在温度、体积一定的条件下, 通入lmol N2和3molH.2 反应后放出的 热量为Q1kJ, 若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ 则184>Q2 >2Q1 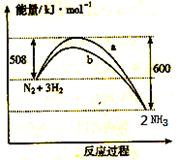
若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图甲所示 反应过程中,混合气体平均相对分子质量为M.,混合气体密度为d,混合气体压强为p,三者关系如图乙 如图丙所示,容器Ⅰ和Ⅱ达到平衡时所需要的时间可能不同 若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
若达到平衡时,测得体系放出9.24 kJ热量,则H2反应速率变化曲线如图甲所示 反应过程中,混合气体平均相对分子质量为M.,混合气体密度为d,混合气体压强为p,三者关系如图乙 如图丙所示,容器Ⅰ和Ⅱ达到平衡时所需要的时间可能不同 若起始加入物料为1 mol N2,3 mol H2,在不同条件下达到平衡时,NH3的体积分数变化如图丁所示
反应①和②产物都只含离子键 反应①和②中,反应物的总能量都比生成物总能量低 由上述反应可知Na的燃烧热为 414 kJ/mol 25℃、101kPa下,Na2O2(s)+2 Na(s)= 2Na2O(s) △H=-317kJ/mol
该反应的热化学方程式为: N2(g)+3H2(g) 2NH3(g) △H=-92kJ·mol-1 a曲线是加入催化剂时的能量变化曲线 加入催化剂,该化学反应的反应热改变 在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2kJ则184>Q2>2Q1
2NH3(g) △H=-92kJ·mol-1 a曲线是加入催化剂时的能量变化曲线 加入催化剂,该化学反应的反应热改变 在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2kJ则184>Q2>2Q1
v(H2)=v(N2)=v (NH3) 3v(H2)=v(N2) v(NH3)= v(H2) v(H2)=3v(N2)
v(H2) v(H2)=3v(N2)
该反应的热化学方程式为: N2+3H2 2 NH3 ΔH=-92 kJ/mol a曲线是加入催化剂时的能量变化曲线 加入催化剂,该化学反应的反应热将发生改变 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1
2 NH3 ΔH=-92 kJ/mol a曲线是加入催化剂时的能量变化曲线 加入催化剂,该化学反应的反应热将发生改变 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1
25℃ 101kPa时,CH4(g)+2O2(g)=CO2(g) +2H2O(g) △H=-Q kJ/mol, 则甲烷的燃烧热为Q kJ/mol CaCO3(s)=CaO(s)+CO2(g) 室温下不能自发进行,说明该反应的 ΔH<0 反应N2(g)+3H2(g) 2NH3(g)ΔH<0达到平衡后,升高温度,反 应速率v(H2)和H2的平衡转化率均增大 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值 均大于零): H2(g) +Cl2(g)=2HCl(g) △H1=—Q1 kJ/mol H2(g) +Br2(g)=2HBr(g) △H2=—Q2 kJ/mol 则△H1<△H2
2NH3(g)ΔH<0达到平衡后,升高温度,反 应速率v(H2)和H2的平衡转化率均增大 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值 均大于零): H2(g) +Cl2(g)=2HCl(g) △H1=—Q1 kJ/mol H2(g) +Br2(g)=2HBr(g) △H2=—Q2 kJ/mol 则△H1<△H2
该反应的热化学方程式为: N2+3H2 2NH3 ΔH=-92 kJ/mol a曲线是加入催化剂时的能量变化曲线 加入催化剂,该化学反应的反应热改变 在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>Q.
2NH3 ΔH=-92 kJ/mol a曲线是加入催化剂时的能量变化曲线 加入催化剂,该化学反应的反应热改变 在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>Q. 

 2NH3(g) ΔH=-38.6 kJ·mol-1 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1 25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为:H2SO4(aq)+2KOH(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1 已知在120 ℃、101 kPa下,1 g H2燃烧生成水蒸气放出121 kJ热量,其热化学方程式为H2(g)+1/2O2(g)===H2O(g) ΔH=-242 kJ·mol-1 25 ℃、101 kPa时,强酸与强碱的稀溶液发生反应的中和热为57.3 kJ·mol-1,硫酸稀溶液与氢氧化钾稀溶液反应的热化学方程式为:H2SO4(aq)+2KOH(aq)= K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
 2NH3(g) ΔH=-92 kJ/mol 在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ
2NH3(g) ΔH=-92 kJ/mol 在温度、体积一定的条件下,通入1 mol N2和3 molH2反应后放出的热量为92kJ
 2NH3, △H = -92kJ·mol-1 a曲线是加入催化剂时的能量变化曲线 加入催化剂, 该化学反应的反应热改变 在温度、体积一定的条件下, 通入lmol N2和3molH.2 反应后放出的 热量为Q1kJ, 若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ 则184>Q2 >2Q1
2NH3, △H = -92kJ·mol-1 a曲线是加入催化剂时的能量变化曲线 加入催化剂, 该化学反应的反应热改变 在温度、体积一定的条件下, 通入lmol N2和3molH.2 反应后放出的 热量为Q1kJ, 若通入2mol N2和6mol H2 反应后放出的热量为Q2kJ 则184>Q2 >2Q1 
 2NH3(g) △H=-92kJ·mol-1 a曲线是加入催化剂时的能量变化曲线 加入催化剂,该化学反应的反应热改变 在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2kJ则184>Q2>2Q1
2NH3(g) △H=-92kJ·mol-1 a曲线是加入催化剂时的能量变化曲线 加入催化剂,该化学反应的反应热改变 在温度体积一定的条件下,通入1mol N2和3 mol H2反应后放出的热量为Q1kJ,若通入 2 mol N2和6mol H2反应后放出的热量为Q2kJ则184>Q2>2Q1
 v(H2) v(H2)=3v(N2)
v(H2) v(H2)=3v(N2)
 2 NH3 ΔH=-92 kJ/mol a曲线是加入催化剂时的能量变化曲线 加入催化剂,该化学反应的反应热将发生改变 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1
2 NH3 ΔH=-92 kJ/mol a曲线是加入催化剂时的能量变化曲线 加入催化剂,该化学反应的反应热将发生改变 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1
 2NH3(g)ΔH<0达到平衡后,升高温度,反 应速率v(H2)和H2的平衡转化率均增大 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值 均大于零): H2(g) +Cl2(g)=2HCl(g) △H1=—Q1 kJ/mol H2(g) +Br2(g)=2HBr(g) △H2=—Q2 kJ/mol 则△H1<△H2
2NH3(g)ΔH<0达到平衡后,升高温度,反 应速率v(H2)和H2的平衡转化率均增大 已知氯气、溴蒸气分别跟氢气反应的热化学方程式如下(Q1、Q2的值 均大于零): H2(g) +Cl2(g)=2HCl(g) △H1=—Q1 kJ/mol H2(g) +Br2(g)=2HBr(g) △H2=—Q2 kJ/mol 则△H1<△H2
 2NH3 ΔH=-92 kJ/mol a曲线是加入催化剂时的能量变化曲线 加入催化剂,该化学反应的反应热改变 在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>Q.
2NH3 ΔH=-92 kJ/mol a曲线是加入催化剂时的能量变化曲线 加入催化剂,该化学反应的反应热改变 在温度、体积一定的条件下,若通入2 mol N2和6 mol H2反应后放出的热量为Q kJ,则184>Q. 