你可能感兴趣的试题
HF的电离常数是① HNO2的电离常数是① HCN的电离常数是② HNO2的电离常数是③
常温下,水分解产生O2,此时平衡常数的值约为5×10-80 常温下,最易分解放出O2的是水  以上都不正确
以上都不正确
HF的电离平衡常数为7.2×10-4 HNO2的电离平衡常数为4.9×10-10 根据①③两个反应即可知三种酸的相对强弱 HNO2的电离平衡常数比HCN大,比HF小
常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2) 常温下,水分解产生O2,此时平衡常数的数值约为5×10-80 常温下,NO、H2O、CO2三种物质分解放出O2的倾向由大到小的顺序为 NO>H2O>CO2 以上说法都不正确
HF的电离平衡常数为7.2×10﹣4 HNO2的电离平衡常数为4.9×10﹣10 根据①③两个反应即可知三种酸的相对强弱 HNO2的电离平衡常数比HCN大,比HF小
HF的电离平衡常数为7.2×10-4 HNO2的电离平衡常数为4.9×10-10 根据①③两个反应即可知三种酸的相对强弱 HNO2的电离平衡常数比HCN大,比HF小
电离平衡常数(K.)与温度无关 H2CO3的电离常数表达式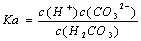 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K123
常温下,NO分解产生O2的反应的平衡常数表达式为K.1=c(N2)·c(O2)/ c(ON) 常温下,水分解产生O2,此时平衡常数的数值约为5×10-80 常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2 以上说法都不正确
K(HF)=7.2×10-4 K(HNO2)=4.9×10-10 酸性:HF>HNO2>HCN K(HCN)<K(HNO2)<K(HF)
常温下,NO分解产生O2的反应平衡常数表达式为K1=[N2][O2] 常温下,水分解产生O2,此时平衡常数的数值约为5×10﹣80 常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2 以上说法都不正确
HF的电离平衡常数为7.2×10-4 HNO2的电离平衡常数为4.9×10-10 根据①③两个反应即可知三种酸的相对强弱 HNO2的电离平衡常数比HCN大,比HF小
HNO2的电离平衡常数是③ HNO2的电离平衡常数是① HCN的电离平衡常数是② HF的电离平衡常数是①
HF的电离平衡常数为7.2×10-4 HNO2的电离平衡常数为4.9×10-10 根据①③两个反应即可知三种酸的相对强弱 HNO2的电离平衡常数比HCN大,比HF小
用HNO2溶液做导电性试验灯光较暗 HNO2是共价化合物 常温下,0.1 mol/L HNO2溶液的pH为2.2 HNO2溶液不与NaCl反应
HF的电离常数是① HNO2的电离常数是① HCN的电离常数是② HNO2的电离常数是③

 以上都不正确
以上都不正确
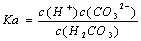 同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1
同温下,电离平衡常数越小表示弱电解质电离能力越弱 多元弱酸各步电离平衡常数相互关系为:K1