你可能感兴趣的试题
电池工作时,MnO2发生还原反应 电池负极的电极反应式为:2MnO2+H2O+2e-→Mn2O3+2OH- 电池工作时,K+移向负极 电池工作时,电路中每通过0.1mol电子,锌的质量理论上减少6.5g
普通锌锰干电池中碳棒为正极 铅蓄电池中覆盖着PbO2的电极板是负极板 氢氧燃料电池的正极是通入氧气的那一极 碱性锌锰干电池的比能量和储存时间比普通锌锰干电池高
电池工作时,锌失去电子 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq) 电池工作时,电子由正极通过外电路流向负极 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
电池工作时,锌失去电子 电池正极的电极反应式为MnO2+2H2O+2e-===Mn(OH)2+2OH- 电池工作时,电子由正极通过外电路流向负极 外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
负极反应为Zn-2e-=Zn2+ 负极反应为Zn+2H2O-2e-= Zn(OH)2+H+ 正极反应为2MnO2+2H++ 2e-=2MnOOH 正极反应为2MnO2+2H2O + 2e-=2MnOOH+2OH-
电池工作时,锌失去电子 电池正极的电极反应式为:MnO2+2H2O+2e-=Mn(OH)2+2OH- 电池工作时,电子由正极通过外电路流向负极 外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
锌锰干电池是二次电池 铝片、锌片、导线和高橙组成的水果电池,负极是锌片 锂电池的电解质可选择KOH溶液 氢氧燃料电池工作时O2为正极,发生还原反应。
电池工作时,锌失去电子 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e-===Mn2O3(s)+2OH-(aq) 电池工作时,电子由正极通过外电路流向负极 外电路中每通过0.1 mol电子,锌的质量理论上减小3.25 g
电池工作时,Zn为负极,负极区PH变大 电池负极的电极反应式为:2MnO2(s)+H2O(l)+2e-===Mn2O3(s)+2OH-(aq) 电池工作时,电子由正极流向负极 电解质氢氧化钾溶液中阳离子迁移到电池的正极
电池工作时,锌失去电子 电池工作时,电子由负极经过电解质溶液流向正极 电池正极的电极反应式为:MnO2(s) +2H2O(l)+2e-═Mn(OH)2 (s)+2OH-(aq) 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
电池中电解质溶液可能是NaOH溶液 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e- == Mn2O3(s)+2OH-(aq) 电池工作时,溶液中的阴离子向锌电极移动 外电路中每通过O.2mol电子,电极锌棒的质量增加6.5g
电池工作时,锌失去电子 电池正极的电极反应式为 MnO2+2H2O+2e-===Mn(OH)2+2OH- 电池工作时,电子由正极通过外电路流向负极 外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
电池工作时,锌失去电子 MnO2为该电池的负极 正极反应为:Zn-2e- = Zn2+ 该电池放电时化学能转换为电能
电池工作时,锌失去电子 电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e- =Mn2O3(s)+2OH- (aq) 电池工作时,电子由正极通过外电路流向负极 外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
电池工作时,锌失去电子 电池正极反应式为: 2MnO2+H2O+2e-= Mn2O3+2OH- 电池工作时,负极附近pH降低 正极是水电离出的H+得到电子
负极反应为Zn-2e-==Zn2+ 负极反应为Zn+2H2O-2e-==Zn(OH)2+H+ 正极反应为2MnO2+2H++2e-==2MnOOH 正极反应为2MnO2+2H2O+2e-==2MnOOH+2OH-
电池工作时,MnO2失去电子 电池工作时,电子由锌经外电路流向MnO2 从反应方程式来看,不使用氢氧化钾,也不影响电流大小 电池的正极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq)

 负极反应为
负极反应为 正极反应为
正极反应为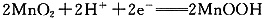 正极反应为
正极反应为