你可能感兴趣的试题
该溶液为饱和溶液 若降温到10℃,溶液质量不变 若升温到40℃,溶质质量分数减小 若升温到50℃,溶质质量分数计算式为: 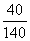 ×100%
×100%
溶剂是挥发性的,溶质是不挥发性的 溶质是挥发性的,溶剂是不挥发性的 溶剂和溶质都是不挥发性的 溶剂和溶质都是挥发性的
0.01mol/L的蔗糖溶液 0.01mol/L的CaCl2溶液 0.02mol/L的NaCl溶液 0.02mol/L的CH3OOH溶液
m(溶质):m(溶剂)=20:100 此时溶液中溶质的质量分数为20% 再加入少量NaCl固体,溶质的质量分数变大 蒸发溶剂析出晶体后,溶液变成不饱和溶液
20℃时,该溶液的溶质质量分数为36% 20℃时,100g饱和溶液中含氯化钠36g 20℃时,100g水中最多溶解氯化钠36g 20℃时,饱和氯化钠溶液不能再溶解其它物质
100g水中最多能溶解某物质40g,则该物质的溶解度为40g 4℃时,溶质N.的饱和溶液120g中含N 20g,所以4℃时,溶质N.的溶解度为20g 一定温度下,物质M.的饱和溶液100g中含M.物质30g,则物质M.在该温度时的溶解度为30g 20℃时,50g水中溶有溶质P 20g,则物质P.在20℃时的溶解度为40g
20℃时,该饱和溶液的溶质质量分数为36% 20℃时,100g饱和溶液中含氯化钠36g 20℃时,100g水中最多能溶解氯化钠36g 20℃时,饱和氯化钠溶液不能再溶解其他物质
100g水中溶解了10g食盐 100g食盐溶液中溶解了10g食盐
将10g食盐溶于90g水中形成的溶液 该溶液中溶质与溶液的质量比为1:10
100ml溶质质量分数为40%(密度为1.3g /ml )的硫酸溶液中含硫酸的质量为40g 30℃时,100g饱和KCl溶液中含 27gKCl,则30C,KCl的溶解度不等于27g 30℃时100g水中最多溶解37gKCl,则30CKCl饱和溶液中溶质的质量分数为37% 20℃时硝酸钾溶液的质量分数为5%,可理解为100g硝酸钾溶液中含硝酸钾5g
100g水中溶解了20g蔗糖 100g蔗糖溶液中溶解了20 g蔗糖 溶液中的溶质是蔗糖,溶剂是水 从20%的蔗糖溶液中取出一滴,这滴溶液中溶质的质量分数仍是20%
稀溶液是指含有少量非挥发性溶质的溶液。 稀溶液的沸点比纯溶剂的沸点高 稀溶液的沸点升高值与溶液中溶质B的质量摩尔浓度成正比。 表达式为
0.01 mol/L的蔗糖溶液 0.01 mol/L的CaCl2溶液 0.02 mol/L的NaCl溶液 0.02 mol/L的CH3COOH溶液
0.02 mol/L的NaCl溶液 0.01 mol/L的CaCl2溶液 0.01 mol/L的蔗糖溶液 0.02 mol/L的CH3COOH溶液
饱和溶液不一定是浓溶液 饱和溶液是不能再溶解任何其它物质的溶液 溶质的质量分数为20%的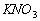 溶液100g取出50g,则剩余溶液中溶质的质量分数为10% NaCl的溶解度是36g,是指在100g水中最多可溶解36gNaCl
溶液100g取出50g,则剩余溶液中溶质的质量分数为10% NaCl的溶解度是36g,是指在100g水中最多可溶解36gNaCl

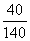 ×100%
×100%

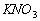 溶液100g取出50g,则剩余溶液中溶质的质量分数为10% NaCl的溶解度是36g,是指在100g水中最多可溶解36gNaCl
溶液100g取出50g,则剩余溶液中溶质的质量分数为10% NaCl的溶解度是36g,是指在100g水中最多可溶解36gNaCl