你可能感兴趣的试题
以NaCl溶液或NaOH溶液为电解液时,正极反应式都为O2+2H2O+4e- = 4OH- 以NaOH溶液为电解液时,负极反应式为Al+3OH--3e-=Al(OH)3↓ 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 电池工作时,电子通过外电路从正极流向负极
以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH- 以NaOH溶液为电解液时,负极反应为:Al+3OH--3e=Al(OH)3↓ 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 电池工作时,电子通过外电路从正极流向负极
由Fe、Cu和FeCl3溶液组成的原电池中,负极反应式为Cu-2e-===Cu2+ 由Al、Cu和稀硫酸组成的原电池中,负极反应式为Cu-2e-===Cu2+ 由Al、Mg和NaOH溶液组成的原电池中,负极反应式为Al+4OH--3e-===AlO-2+2H2O 由Al、Cu和浓HNO3组成的原电池中,负极反应式为Al-3e-===Al3+
以NaCl溶液或NaOH溶液为电解液时,正极反应都为:O2+2H2O+4e-=4OH- 以NaOH溶液为电解液时,负极反应为:Al+3OH--3e=Al(OH)3↓ 以NaOH溶液为电解液时,电池在工作过程中电解液的pH保持不变 电池工作时,电子通过外电路从正极流向负极
铝是还原剂,其还原产物是Al(OH)3 NaOH是氧化剂,其还原产物是H2 铝是还原剂,H2O和NaOH都是氧化剂 H2O是氧化剂,Al被氧化
由Al、Cu、稀H2SO4组成的原电池,其负极反应式为Al-3e-=Al3+
由Mg、Al、NaOH溶液组成的原电池,其负极反应式为Al+4OH--3e-=AlO2-+2H2O
由Fe、Cu、FeCl3溶液组成的原电池,其负极反应式为Cu-2e-=Cu2+
由Al、Cu、浓硝酸组成的原电池,其负极反应式为Cu-2e-=Cu2+
图1中甲可能是Cl2,X.可能是Fe 图2中反应一定是置换反应或复分解反应 图3中是向某溶液中滴加NaOH溶液的变化图像,原溶质可能是Al2(SO4)3 图4中a可能为NaOH,b可能为Na2CO3,c可能为NaHCO3
参加反应的CO2的体积为0.224 aL. 用上述数据不能确定NaOH溶液的物质的量浓度 若a=b,则CO2与NaOH溶液反应的产物盐只有Na2CO3 b可能等于a、小于a或大于a
由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al﹣3e﹣=Al3+ 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al﹣3e﹣+4OH﹣=AlO2﹣+2H2O 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu﹣2e﹣=Cu2+ 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu﹣2e﹣=Cu2+
由Al、Cu、稀硫酸组成的原电池,其负极反应式为Al-3e-===Al3+ 由Al、Mg、NaOH溶液组成的原电池,其负极反应式为 Al-3e-+4OH-===AlO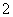 +2H2O 由Fe、Cu、FeCl3溶液组成的原电池,其负极反应式为Cu-2e-===Cu2+ 由Al、Cu、浓硝酸组成的原电池,其负极反应式为Cu-2e-===Cu2+
+2H2O 由Fe、Cu、FeCl3溶液组成的原电池,其负极反应式为Cu-2e-===Cu2+ 由Al、Cu、浓硝酸组成的原电池,其负极反应式为Cu-2e-===Cu2+
Al、Cu、稀H2SO4组成原电池,负极反应式为:Al-3eˉ=Al3+ Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3eˉ+4OHˉ=AlO2ˉ+2H2O 由Al、Cu、浓硝酸组成原电池,负极反应式为:Cu-2eˉ=Cu2+ 由Fe、Cu、FeCl3溶液组成原电池,负极反应式:Cu-2eˉ=Cu2+
由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3e-=Al3+ 由Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3e-+4OH.-=AlO2-+2H2O 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-=Cu2+ 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-=Cu2+
Mg和Al的总质量为8 g 硫酸的物质的量浓度为5 mol・L─1 NaOH溶液的物质的量浓度为5 mol・L─1 生成的H2在标准状况下的体积为11.2L.
由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al - 3eˉ=Al3+ 由Mg、Al、NaOH溶液组成原电池,其负极反应式为: Al - 3eˉ+ 4OHˉ=AlO2ˉ+ 2H2O 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu - 2eˉ=Cu2+ 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu - 2eˉ=Cu2+
盐酸与铝片反应后,盐酸还有剩余 图中B.点之前发生的离子反应为Al3++3OH-=Al(OH)3↓ A.→B段消耗的NaOH体积与B.→C段消耗的Na0H体积比≥3:1 溶解铝片的盐酸浓度与滴加的NaOH溶液浓度相等
Al(OH)3既能够与盐酸反应又能够与NaOH溶液反应 这种吸附剂也能吸附色素 向Al2(SO4)3溶液中加入过量的NaOH溶液也能得到Al(OH)3 实验室中Al(OH)3可以由可溶性铝盐溶液与足量的氨水反应制得
由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu一2e—=Cu2+ 由Mg、Al、NaOH溶液组成电池,其负极反应式为:Al一3e一=Al3+ 由Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al一3e一=Al3+ 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Al一3e一=Al3+
由Al、Cu、稀硫酸组成原电池,其负极反应式为:Al-3e-===Al3+ 由Mg、Al、NaOH溶液组成原电池,其负极反应式为: Al-3e-+4OH-===AlO +2H2O 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+ 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-===Cu2+
+2H2O 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+ 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-===Cu2+
由Al、Cu、稀硫酸组成原电池,其负极反应式为Al-3e-===Al3+ 由Mg、Al、NaOH溶液组成原电池,其负极反应式为Al-3e-+4OH-===AlO +2H2O 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为Cu-2e-===Cu2+ 由Al、Cu、浓硝酸组成原电池,其负极反应式为Cu-2e-===Cu2+
+2H2O 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为Cu-2e-===Cu2+ 由Al、Cu、浓硝酸组成原电池,其负极反应式为Cu-2e-===Cu2+
有Al、Cu、稀H2SO4组成原电池,其负极反应式为:Al-3 e-==Al3+ Mg、Al、NaOH溶液组成原电池,其负极反应式为:Al-3 e-==Al3+ 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-==Cu2+ 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-==Cu2+

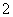 +2H2O 由Fe、Cu、FeCl3溶液组成的原电池,其负极反应式为Cu-2e-===Cu2+ 由Al、Cu、浓硝酸组成的原电池,其负极反应式为Cu-2e-===Cu2+
+2H2O 由Fe、Cu、FeCl3溶液组成的原电池,其负极反应式为Cu-2e-===Cu2+ 由Al、Cu、浓硝酸组成的原电池,其负极反应式为Cu-2e-===Cu2+
 +2H2O 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+ 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-===Cu2+
+2H2O 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为:Cu-2e-===Cu2+ 由Al、Cu、浓硝酸组成原电池,其负极反应式为:Cu-2e-===Cu2+
 +2H2O 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为Cu-2e-===Cu2+ 由Al、Cu、浓硝酸组成原电池,其负极反应式为Cu-2e-===Cu2+
+2H2O 由Fe、Cu、FeCl3溶液组成原电池,其负极反应式为Cu-2e-===Cu2+ 由Al、Cu、浓硝酸组成原电池,其负极反应式为Cu-2e-===Cu2+