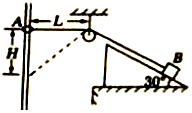
A.圆环下降的过程中,轻绳的张力大小始终等于10N
圆环能下降的最大距离为Hm=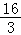 m 圆环速度最大时,轻绳与直杆的夹角为30° 若增加圆环质量使m=1kg,再重复题述过程,则圆环在下降过程中,重力做功的功率一直在增大
m 圆环速度最大时,轻绳与直杆的夹角为30° 若增加圆环质量使m=1kg,再重复题述过程,则圆环在下降过程中,重力做功的功率一直在增大
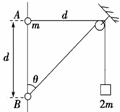
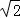 ﹣1)d 环到达B处时,环与重物的速度大小相等 环从A到B,环减少的机械能等于重物增加的机械能 环能下降的最大高度为
﹣1)d 环到达B处时,环与重物的速度大小相等 环从A到B,环减少的机械能等于重物增加的机械能 环能下降的最大高度为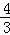 d
d
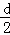 环到达B处时,环与重物的速度大小相等 环从A到B,环减少的机械能等于重物增加的机械能 环能下降的最大高度为
环到达B处时,环与重物的速度大小相等 环从A到B,环减少的机械能等于重物增加的机械能 环能下降的最大高度为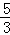 d
d
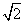 -1)d 小环在B.处的速度与重物上升的速度大小之比等于
-1)d 小环在B.处的速度与重物上升的速度大小之比等于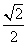 小环能够下滑的最大距离为4d/3
小环能够下滑的最大距离为4d/3