你可能感兴趣的试题
右图可表示由CO生成CO2的反应过程和能量关系
CO的燃烧热为283kJ/mol
2 Na2O2(s)+2 CO2(s)=2 Na2CO3(s)+O2(g) △H.>﹣452kJ/mol
CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为2NA
B.C.D.四种钠的化合物,除一种为淡黄色外,其余均为白色粉末,已知四种物质可分别发生如下反应: ①A+C―→B+H2O ②D+CO2―→B+O2 ③D+H2O―→C+O2 ④A―→B+H2O+CO2 则A. C.D.四种物质分别为( ) A.NaHCO3、Na2CO3、NaOH、Na2O2 B.Na2CO3、NaHCO3、NaOH、Na2O2 NaHCO3、NaOH、Na2CO3、Na2O2 NaOH、Na2CO3、NaHCO3、Na2O2
生成0.1 mol O2转移0.4mol电子 相同条件下足量Na2O2吸收10LCO2放出5LO2 氧化剂是Na2O2,还原剂是CO2 在Na2O2+SO2═Na2SO4的反应中,SO2的作用跟CO2相同
CO的燃烧热为283 kJ 右图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H= - 452 kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2x6.02×l023
CO的燃烧热为566 kJ/mol 右图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH.>-452 kJ/mol CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移的物 质的量为为2 mol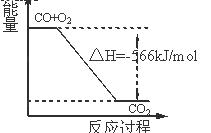
CO的燃烧热为283 kJ 右图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH.>-452 kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为NA 上图可表示由2molCO和1molO2生成2molCO2的反应过程 和能量关系 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) Δ H>-452 kJ/mol CO的燃烧热为283 kJ/mol
Na2O2与Na2CO3 Na2CO3 NaOH和Na2CO3 Na2CO3、Na2O2、NaOH
Na2CO3 NaOH和Na2CO3 Na2O2和Na2CO3 Na2O2、NaOH和Na2CO3
Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物 Na2O与CO2发生化合反应生成Na2CO3,Na2O2将CO2还原为Na2CO3 分别向Na2O2和Na2O与水反应后的溶液中立即滴入酚酞溶液,现象相同 Na2O是白色物质,Na2O2是淡黄色物质
CO的燃烧热ΔH= -566 kJ/mol CO的热值约为10.1kJ/g 2Na2O2(s) + 2CO2(s)= 2Na2CO3(s) + O2(g) ΔH.< -452 kJ/mol CO(g)与Na2O2(s)反应放出50.9 kJ热量时,电子转移为0.1mol
C.→CO→CO2→Na2CO3 Fe→Fe3O4→Fe(OH)3→FeCl3 Na→Na2O2→Na2CO3→NaOH N2→NO→NO2→HNO3
CO的燃烧热为283 kJ 下图可表示由CO生成CO2的反应过程和能量关系  CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
Na2CO3、Na2O2和O2 Na2CO3、O2和H2O(g) Na2CO3、CO2、O2和H2O(g) NaHCO3、Na2CO3和O2
Na2CO3、Na2O2、O2 Na2CO3、O2 Na2CO3、NaOH、CO2、O2 Na2CO3、O2、H2O(g)


 CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1