你可能感兴趣的试题
正极反应为Zn–2e-=Zn2+ 左烧杯中溶液的红色变浅
Pt电极上有气泡出现  该电池总反应为3Zn + 2Fe3+ = 2Fe + 3Zn2+
该电池总反应为3Zn + 2Fe3+ = 2Fe + 3Zn2+
Zn为负极,Cu为正极 正极反应为 Zn﹣2e﹣═Zn2+ 负极反应为Cu﹣2e﹣═Cu2+ 该装置能将电能转化为化学能
正极反应为 放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移O..01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移O..01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
正极反应为AgCl+e-===Ag+Cl- 放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 
正极反应为AgCl+e- Ag+Cl- 放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol 离子
Ag+Cl- 放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol 离子
正极反应为AgCl +e— =Ag +Cl- 放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移0.01 mol e-时,交换膜左侧溶液中约 减少0.02 mol离子
正极反应为AgCl +e-=Ag +Cl- 放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
正极反应为AgCl+e-===Ag+Cl- 放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移0.01mol e-时,交换膜左侧溶液中约减少0.02mol离子
正极反应为AgCl+e-=Ag+Cl- 放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
正极反应为AgCl+e-===Ag+Cl- 放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
锌做负极发生氧化反应 电池的总反应为:Zn + 2H+ = Zn2+ + H2↑ 该装置可实现化学能转化为电能 溶液中硫酸根离子向Cu极移动
锌做负极发生氧化反应 供电时的总反应为:Zn+2H+=Zn2++H2↑ 该装置可实现化学能转化为电能 产生1 g H2,消耗锌的质量65 g
供电时的总反应为:Zn+2H+=Zn2++H2↑ 该装置可实现化学能转化为电能 产生1 g H2,消耗锌的质量65 g
铜电极上的反应为Cu-2e-==Cu2+ 放电时溶液中的阳离子向锌片移动 电池正极发生氧化反应 该电池的负极材料是锌片 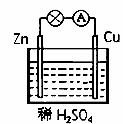
正极反应为AgCl+e-==Ag+Cl- 放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移0.01 mole-时,交换膜左侧溶液中约减少0.02 mol离子
该原电池的正极反应是Zn-2e-===Zn2+ 左烧杯中溶液的血红色逐渐褪去 该电池铂电极上有气泡出现 该电池总反应为3Zn+2Fe3+===2Fe+3Zn2+
正极反应为AgCl + e− Ag+Cl− 放电时,交换膜右侧溶液中有大量白色沉淀生成 当电路中转移0.01 mol e−时,交换膜左侧溶液中 约减少0.02 mol离子 若用NaCl溶液代替盐酸,则电池总反应随之改变
Ag+Cl− 放电时,交换膜右侧溶液中有大量白色沉淀生成 当电路中转移0.01 mol e−时,交换膜左侧溶液中 约减少0.02 mol离子 若用NaCl溶液代替盐酸,则电池总反应随之改变
正极反应为AgCl+e-===Ag+Cl- 放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 
正极反应为AgCl+e-===Ag+Cl- 放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
该原电池的正极反应是Zn-2e-===Zn2+ 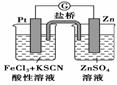 左烧杯中溶液的血红色逐渐褪去 该电池铂电极上有气泡出现 该电池总反应为3Zn+2Fe3+===2Fe+3Zn2+
左烧杯中溶液的血红色逐渐褪去 该电池铂电极上有气泡出现 该电池总反应为3Zn+2Fe3+===2Fe+3Zn2+

 该电池总反应为3Zn + 2Fe3+ = 2Fe + 3Zn2+
该电池总反应为3Zn + 2Fe3+ = 2Fe + 3Zn2+ 放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移O..01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移O..01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子

 Ag+Cl- 放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol 离子
Ag+Cl- 放电时,交换膜右侧溶液中有大量白色沉淀生成 若用NaCl溶液代替盐酸,则电池总反应随之改变 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol 离子
 供电时的总反应为:Zn+2H+=Zn2++H2↑ 该装置可实现化学能转化为电能 产生1 g H2,消耗锌的质量65 g
供电时的总反应为:Zn+2H+=Zn2++H2↑ 该装置可实现化学能转化为电能 产生1 g H2,消耗锌的质量65 g

 Ag+Cl− 放电时,交换膜右侧溶液中有大量白色沉淀生成 当电路中转移0.01 mol e−时,交换膜左侧溶液中 约减少0.02 mol离子 若用NaCl溶液代替盐酸,则电池总反应随之改变
Ag+Cl− 放电时,交换膜右侧溶液中有大量白色沉淀生成 当电路中转移0.01 mol e−时,交换膜左侧溶液中 约减少0.02 mol离子 若用NaCl溶液代替盐酸,则电池总反应随之改变

 左烧杯中溶液的血红色逐渐褪去 该电池铂电极上有气泡出现 该电池总反应为3Zn+2Fe3+===2Fe+3Zn2+
左烧杯中溶液的血红色逐渐褪去 该电池铂电极上有气泡出现 该电池总反应为3Zn+2Fe3+===2Fe+3Zn2+