你可能感兴趣的试题
H2O2分解的化学方程式:H2O2 ═ H2O+O2↑ H2O2分解速率主要由反应②控制 反应活化能等于98 kJ·mol-1 IO-是该反应的中间产物
反应的速率与I.-的浓度有关 IO-也是该反应的催化剂
反应活化能等于98 KJ•mol-1 v(H2O2)=v(H2O)=v(O2)
∆H.1 + ∆H.2 = ∆H. I.-是H2O2分解反应的催化剂 欲分解2 mol H2O2(l),至少需要提供98 kJ的热量 若生成1 mol O2,则反应ii转移电子的物质的量为2 mol
反应的速率与I.-的浓度有关 IO-也是该反应的催化剂
反应活化能等于98 KJ•mol-1 v(H2O2)=v(H2O)=v(O2)
反应速率与I.﹣的浓度有关 IO﹣也是该反应的催化剂 反应活化能等于98kJ•mol﹣1 v(H2O2)=v(H2O)=v(O2)
反应速率与I.-浓度有关 IO-也是该反应的催化剂 反应活化能等于98 kJ·mol-1 v(H2O2)=v(H2O)=v(O2)
IO-是该反应的催化剂 反应的速率与I- 浓度有关 v(H2O2)= v(H2O)= v(O2) 反应活化能等于98 kJ·mol-1
反应速率与I-浓度有关 IO-也是该反应的催化剂 反应活化能等于98 kJ·mol-1 v(H2O2)=v(H2O)=v(O2)
反应活化能为98 kJ·mol–1 反应速率与I–浓度有关 IO–是该反应的催化剂 υ(H2O2)=υ(H2O)=υ(O2)
IO-是该反应的催化剂 反应速率与I.-浓度有关 反应活化能等于98 kJ•mol-1 v(H2O2)=v(H2O)=v(O2)
反应的速率与I.-的浓度有关 IO-也是该反应的催化剂 反应活化能等于98KJ·mol-1 v(H2O2)=v(H2O)=v(O2)
反应速率与I-浓度有关 IO-也是该反应的催化剂 反应活化能等于98 kJ·mol-1 v(H2O2)=v(H2O)=v(O2)
反应速率与I.-的浓度有关 IO-也是该反应的催化剂 反应活化能等于98kJ·mol-1 v(H2O2)=v(H2O)=v(O2)
反应速率与I.-的浓度有关 IO-也是该反应的催化剂 反应物的总能量小于生成物的总能量 2v(H2O2)=2v(H2O)=v(O2)
①式表示25℃,101 kPa时,2 mol H2和1 mol O2完全燃烧生成2 mol H2O(l)放热571.6 kJ 2H2(g)+O2(g) === 2H2O(g)中ΔH.大于-571.6 kJ/mol 含1molNaOH的水溶液与50g98%的硫酸混合后放出的热量为57.3 kJ 将含1 mol NaOH的稀溶液与含1 mol CH3COOH的稀溶液混合后放出的热量小于57.3 kJ
反应速率与I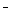 浓度有关 IO
浓度有关 IO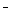 也是该反应的催化剂 反应活化能等于98kJ·mol-1
也是该反应的催化剂 反应活化能等于98kJ·mol-1 
I.-是该反应的催化剂,它可增加该反应的活化分子百分数 当反应放出98 kJ的热量时,会生成1mol O2 反应速率与I.-的浓度无关 2v(H2O2)=2v(H2O)=v(O2)
可以用带火星的木条检验H2O2是否开始分解 IO-在反应Ⅰ中是氧化产物,在反应Ⅱ中是氧化剂 在H2O2溶液中加入NaIO也能提高H2O2分解速率 △H1+△H2  -98KJ/mol
-98KJ/mol
反应速率与I.-的浓度有关 IO-也是该反应的催化剂 反应活化能等于98 kJ·mol-1 v(H2O2)=v(H2O)=v(O2)
反应速率与I.-浓度有关 IO-也是该反应的催化剂 反应活化能等于98 kJ·mol-1 v(H2O2)=v(H2O)=v(O2)

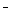 浓度有关 IO
浓度有关 IO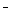 也是该反应的催化剂 反应活化能等于98kJ·mol-1
也是该反应的催化剂 反应活化能等于98kJ·mol-1 
 -98KJ/mol
-98KJ/mol