你可能感兴趣的试题
25 ℃时,0.1 mol·L-1 HF溶液中pH=1 K.sp(CaF2)随温度和浓度的变化而变化 该体系中没有沉淀产生 该体系中HF与CaCl2反应产生沉淀
其他条件不变时增大压强,能使全气体反应体系中活化分子百分数增加 中和反应都是放热反应 在FeCl3溶液和KSCN溶液反应的平衡体系中,加入KCl固体,平衡逆向移动 熵增大的反应不一定自发, 但自发反应熵一定增大
向上述体系中加入CCl4,平衡不移动 25 C时,向上述体系中加入少量I2,平衡向右移动, 平衡常数大于680 该反应的平衡常数表达式为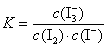 该反应的正反应为放热反应
该反应的正反应为放热反应
反应后的溶液最多还能溶解1. 4 g Fe 反应后溶液中 c(NO3-)=0.85 mol • L-1 反应后溶液中铁元素可能以Fe2+形式存在 1.12L.气体可能是NO、NO2的混合气体
25 ℃时,0.1 mol·L-1 HF溶液中pH=1 Ksp(CaF2)随温度和浓度的变化而变化 该体系中没有沉淀产生 该体系中HF与CaCl2反应产生沉淀
温度高,焓值高 焓值高,做功全过程不产生相变化 温度高,做功全过程不产生相变化
25℃时,0.1 mol/L HF溶液中pH=1 K.sp(CaF2)随温度和浓度的变化而变化 该体系中没有沉淀产生 该体系中HF与CaCl2反应产生沉淀
不发生相变化,能耗低 适用于热敏性物质 适用于特殊溶液体系的分离 不会出现浓度差极化现象 装置简单容易操作
25℃时,0.1 mol·L-1 HF溶液中pH=1 K.sp(CaF2)随温度和浓度的变化而变化 该体系中没有沉淀产生 该体系中HF与CaCl2反应产生沉淀
25℃时,0.1 mol/L HF溶液中pH=1 Ksp(CaF2)随温度和浓度的变化而变化 该体系中没有沉淀产生 该体系中HF与CaCl2反应产生沉淀
反应混合物的浓度 反应体系的压强 正、逆反应的速率 反应体系的温度
正反应为放热反应,W.为气体 正反应为放热反应,W为固体 正反应为吸热反应,W.为固体或液体 正反应为放热反应,W.为固体或液体
体系中气体的密度发生变化 体系中各组分的物质的量浓度发生变化 体系中各组分的体积分数发生变化 正反应和逆反应速率均发生变化
向上述体系中加入CCl4,平衡不移动 25 C时,向上述体系中加入少量I2,平衡向右移动, 平衡常数大于680 该反应的平衡常数表达式为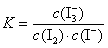 该反应的正反应为放热反应
该反应的正反应为放热反应
改变反应体系的温度 改变反应的途径 改变反应物的浓度 改变反应体系所使用的催化剂
25℃时,0.1 mol·L-1HF溶液中pH=1 K.sp(CaF2)随温度和浓度的变化而变化 该体系中没有沉淀产生 该体系中HF与CaCl2反应产生沉淀

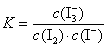 该反应的正反应为放热反应
该反应的正反应为放热反应
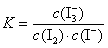 该反应的正反应为放热反应
该反应的正反应为放热反应