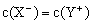你可能感兴趣的试题
5.8×10-2 9.8×10-3 8.6×10-7 7.9×10-8
室温下,测0.1mol/L HX溶液的pH,若pH>1,证明HX是弱酸 室温下,测1mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 在相同条件下,对0.1 mol/L的HCl和0.1mol/L的HX进行导电性实验,若HX溶液灯泡较暗,证明HX为弱酸
室温下,测0.1mol/L HX溶液的pH ,若pH>1,证明HX是弱酸 室温下,测1mol/L NaX溶液的pH ,若pH>7,证明HX是弱酸 将等浓度、等体积HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸 在相同条件下,对0.1 mol/L的盐酸和0.1mol/L的HX溶液进行导电性实验,两者相比较HX溶液灯泡相对较暗,证明HX为弱酸
5.8×10-2 9.8×10-3 8.6×10-7 7.9×10-8
室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是弱酸 室温下,测1 mol/L NaX溶液的pH,若pH>7,证明HX是弱酸 相同条件下,对0.1 mol/L的HCl和0.1 mol/L的HX进行导电性实验,若与HX溶液相串联的灯泡较暗,证明HX为弱酸 将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸
5.8×10-2 9.8×10-3 8.6×10-7 7.9×10-8
常温下,等浓度、等体积的NaHCO3 溶液pH小于 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和 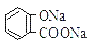 溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者 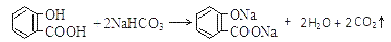 水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
从甲组情况分析,若a=7,则HX为强酸;若a>7,则HX为弱酸 在乙组混合溶液中,离子浓度c(X-)=c(Na+) 从丙组实验结果分析,HX是弱酸 丁组实验所得混合溶液中,由水电离出的c(OH-)=10-10 mol/L
H2SO3(Ka1=1.3×10-2;Ka2=6.3×10-8) H2CO3(Ka1=4.2×10-7;Ka2=5.6×10-11) H2C2O4(Ka1=5.9×10-2;Ka2=6.4×10-5) H3PO3(Ka1=5.0×10-2;Ka2=2.5×10-7)
①为强酸的滴定曲线 酸性:HX>HY>HZ 滴定HX溶液可用酚酞作指示剂 HZ+Y- HY+Z-的平衡常数为K=1×103
HY+Z-的平衡常数为K=1×103
5×10-10 4×10-10 5×10-9 4×10-9
若HX是弱酸,YOH是强碱,则两溶液浓度相等 若HX是强酸,YOH是弱碱,则两溶液体积相等 若HX是弱酸,YOH是强碱,则两溶液体积一定是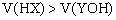 在混合后的中性溶液中,
在混合后的中性溶液中,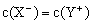
 溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和
溶液pH 常温下,等浓度、等体积的Na2 CO3 溶液和  溶液中所含离子总数前者小于后者
溶液中所含离子总数前者小于后者  水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
水杨酸的第二级电离 Ka2 远小于第一级电离Ka1 的原因之一是 能形成分子内氢键
 HY+Z-的平衡常数为K=1×103
HY+Z-的平衡常数为K=1×103
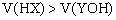 在混合后的中性溶液中,
在混合后的中性溶液中,