你可能感兴趣的试题
酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸学科网 锥形瓶用蒸馏水洗净后,润洗后加入一定体积的未知浓度的NaOH溶液 滴定时,没有逐出滴定管下口的气泡 读数时,视线与滴定管内液体的凹液面最低处保持水平
取干燥洁净的酸式滴定管立即装入标准盐酸 用蒸馏水洗净锥形瓶后,立即装入一定体积的NaOH溶液后进行滴定 往盛有20.00 mL NaOH溶液的锥形瓶中,滴入几滴酚酞指示剂后进行滴定 用蒸馏水洗净锥形瓶后,再用NaOH溶液润洗,然后装入一定体积的NaOH溶液
氢离子浓度相等 H2SO4和HAc的浓度相等 H2SO4的浓度为HAc浓度的1/2 H2SO4和HAc的电离度相等
当V(NaOH)=0 mL时,c(X-)>c(Y-) a点时:c(Y-)+c(HY)=0.100 0 mol·L-1 b点时:c(HX)>c(Na+)>c(X-)>c(OH-)>c(H+) 当V(NaOH)=20.00 mL时,NaX、NaY两溶液中的阴离子总数相对大小:N.前者>N后者
HX为弱酸 M.点c(HX)-c(X-)﹥c(OH-)-c(H+) 将P.点和N.点的溶液混合,呈酸性 向N.点的溶液中通入HCl至pH=7:c(Na+) ﹥c(HX)=c(Cl-) >c(X-)
HA为弱酸,BOH为强碱 a点时,溶液中粒子浓度存在关系: c(B.+) > c(Cl-) > c(OH-) > c(BOH) c、d两点溶液混合后微粒之间存在关系: c(H+) = c(OH-) + c(BOH) b点时两种溶液中水的电离程度相同,且V.=20
酸式滴定管用蒸馏水洗净后,直接加入已知浓度的盐酸 锥形瓶用蒸馏水洗净后,润洗后,加入一定体积的未知浓度的NaOH溶液 滴定时,没有逐出滴定管下口的气泡 滴定时,眼睛注视锥形瓶内溶液颜色的变化
在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX 根据滴定曲线,可得K.a(HY)≈10—5 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+) HY与HZ混合,达到平衡时:c(H+)=  + c(Z-) +c(OH-)
+ c(Z-) +c(OH-) 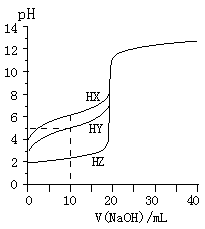
4V(NaOH)=3V(KMn04) 5V(NaOH)=V(KMn04) V(NaOH)=V(KMn04) 3V(NaOH)=4V(KMn04)
在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ>HY>HX 用NaOH溶液滴定HY,当V.(NaOH) = 10mL时溶液中c(Y-)>c(Na+)>c(H+)>c(OH-) 用NaOH溶液滴定HX,当V.(NaOH)=10mL时溶液中2c(Na+)=c(X-)+c(HX) 当三种酸均滴定至pH=7时,HZ所用NaOH溶液体积最小
图1可以表示用NaOH溶液滴定1 mol·L-1的稀盐酸 图1可以表示用NaOH溶液滴定1 mol·L-1的稀醋酸 图2可以表示在MgCl2中逐滴加入相同浓度相同体积的NaOH溶液 图2可以表示在稀盐酸中逐滴加入相同浓度相同体积的NaOH溶液 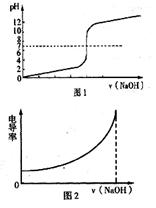
浓度均为0.1 mol·L-1的 HCOONa和NH4Cl 溶液中阳离子的物质的量浓度之和:前者小于后者 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 0.2 mol·L-1 HCOOH 与 0.1 mol·L-1 NaOH 等体积混合后的溶液中: c(HCOO-) + c(OH-) = c(HCOOH) + c(H+) 0.10 mol·L-1CH3COONa溶液中通入HCl至溶液呈中性:c(Na+)>c(Cl-)=c(CH3COOH)
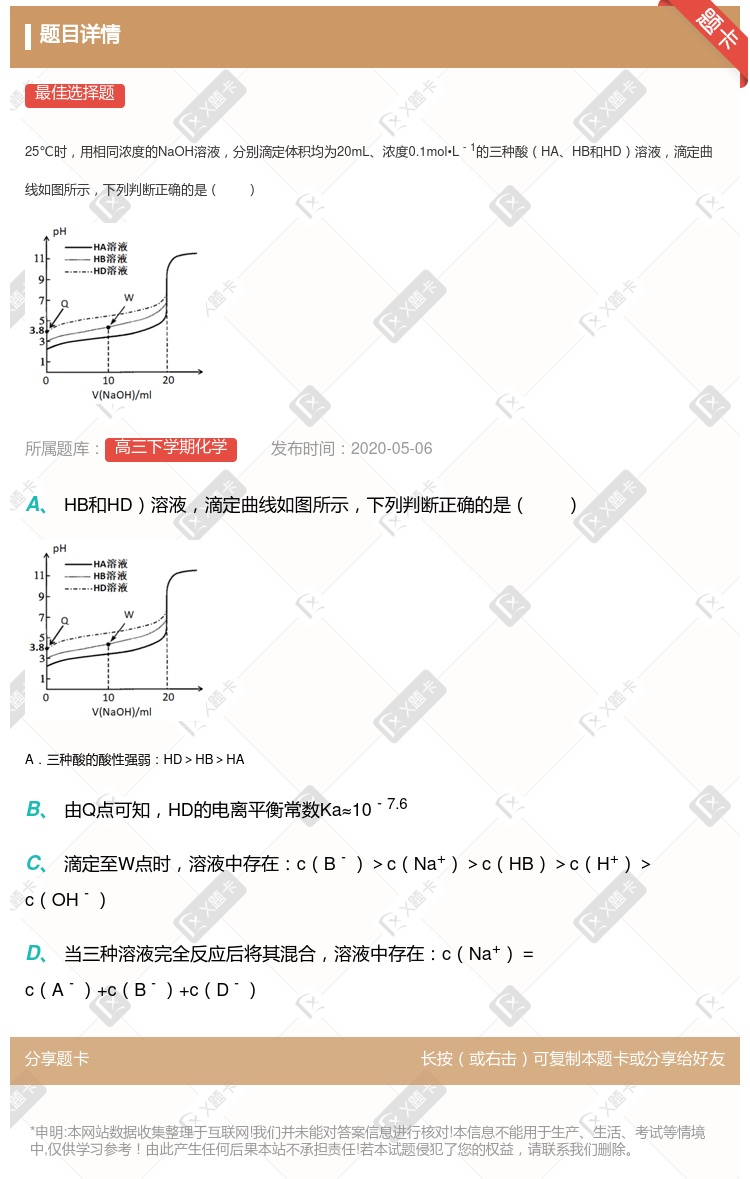
 + c(Z-) +c(OH-)
+ c(Z-) +c(OH-) 
