你可能感兴趣的试题
图①表示25℃时,和0.1mol·L-1盐酸滴定20mL 0.1mol·L-1NaOH溶液 图②表示常温下,等量锌粉与足量的等体积等浓度的盐酸反应 图③表示向CaCl2和盐酸的混合溶液中滴加Na2CO3溶液 图④表示向盐酸和醋酸混合溶液中滴入氨水
H2A在水溶液中的电离方程式为:H2A=H++HA-,HA- H++A2- 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-) 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 0.0l mol·L-l的NaHA溶液pH>2
H++A2- 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-) 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 0.0l mol·L-l的NaHA溶液pH>2
2-)所示。根据图示判断,下列说法正确的是( ) A.当V(NaOH)=20 mL时,溶液中离子浓度大小 关系:c(Na+)>c(HA-)> c(A2-) > c(H+) >c(OH-) 等浓度的NaOH溶液与H2A溶液按2:1混合后, 其溶液中水的电离程度比纯水大 NaHA溶液中:c(OH—)=c(H+)+c(HA–)+2c(H2A) 向上述加入20mLNaOH溶液后所得溶液中再加入水的过程中,pH可能减少
在Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3)
在pH=8的NaB溶液中:c(Na+)-c(B-)=9.9×10-7 mol/L
浓度均为0.1 mol/L的NaClO、NaHCO3混合溶液中:  c(HClO)+c(ClO-)=c(HCO3-) +c(H2CO3)
c(HClO)+c(ClO-)=c(HCO3-) +c(H2CO3)
向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则混合液体积V.总≥20mL
在常温下SiO2(s)+2C(s)=Si(s)+2CO(g)不能自发进行,则该反应的∆H.>0  常温下,NH4Cl溶液加水稀释, 不变 向硅酸钠溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解 如图可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
常温下,NH4Cl溶液加水稀释, 不变 向硅酸钠溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解 如图可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
先在试管中加入发酵液2mL,再滴加3滴重铬酸钾溶液 | 先在试管中加入发酵液2mL,,再加人3 mol×L-1的H2SO43滴,摇匀,再滴加常温下饱和的重铬酸钾溶液3滴 |
| 直接将2mL重铬酸钾倒入发酵液中 |
| 用试管取2mL发酵液在酒精灯上加热,待温度降至常温时,再往里面加入3滴mol×L-1的H2SO4,摇匀后,再加入3滴常温下饱和的重铬酸钾溶液 |
在Na2CO3溶液中:c(OH﹣)﹣c(H+)═ c(HCO3﹣)+c(H2CO3) 在pH=8的NaB溶液中:c(Na+)﹣c(B.﹣)= 9.9×10﹣7 mol/L 浓度均为0.1 mol/L的NaClO、NaHCO3混合溶液中: c(HClO)+c(ClO﹣)═c(HCO3﹣)+c(H2CO3) 向10mL pH=12的NaOH溶液中滴加pH=2的HA溶液达中性:则混合液体积V.总≥20mL
常温下,20mL中含X.、Y.各0.003mol的溶液 常温下,100mL中含X.、Y.各0.005mol的溶液 常温下,0.1mol/L.的X.、Y.溶液各l0mL相混合 标准状况下,0.1mol/L.的X.、Y.溶液各l0mL相混合
稀硫酸的浓度为0.1mol/L C.点溶液pH=14-a E.溶液中存在:c(NH4+)>c(SO42-)>c(H+)>c(OH-) B.到D.D.到F.所加氨水体积一定相等 
常温下,0.l mol/L氨水的电离常数K.约为l×l0-5 mol.L-1 a、b之间的点一定满足:c(NH4+)>c(Cl-)>c(OH-)> c(H+) c点溶液中c(NH4+)=c(Cl-) d点代表两溶液恰好完全反应
元素的有关微粒的物质的量变化如下图。根据图示判断,下列说法正确的是  A.H2A在水中的电离方程式是:H2A===H++HA-、HA-
A.H2A在水中的电离方程式是:H2A===H++HA-、HA- H++A.2- 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-) 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)> c(OH-)
H++A.2- 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-) 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)> c(OH-)
V=20mL 在点①所示溶液中: c(Cl-)=c(H+) 在点②所示溶液中: c(H+)=c(NH3·H2O)+c(OH-) 在点②、③之间可能存在: c(NH4+)>c(Cl-)=c(OH-)>c(H+)
常温下同浓度的强酸、强碱等体积混合后由水电离出的c(H+) =10-7mol·L-l 常温下pH =2的盐酸和pH =12的氨水等体积混合后c(C1-)+c(H+)=c(NH4+)+c(OH-) 常温下0.1 mol.L.-1的Na2A溶液的pH=10,则该溶液中由水电离的c(OH-)= 10 -10 mol.L.-l 常温下向10 mL0.1 mol.L.-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中, 将减小
将减小
在Na2CO3溶液中:c(OH-)-c(H+)═c(HCO3-)+c(H2CO3) 在pH=8的NaB溶液中:c(Na+)-c(B-)=9.9×10-7 mol/L 浓度均为0.1 mol/L的NaClO、NaHCO3混合溶液中: c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3) 向10mLpH=12的NaOH溶液中滴加pH=2的HA溶液达中性,则混合溶液的体积 V.总≥20Ml
V.=40 C.点所示溶液中:c(H+ )-c(OH-) =2c(NH3.H2O) NH3.H2O的电离常数K.=10-4 d点所示溶液中:c(NH4+) =2c(SO42-) 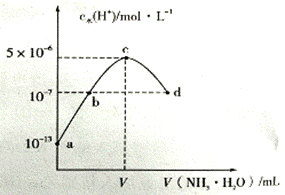
图中V=40 c点所示溶液中c(H+)-c(OH-)=2c(NH3·H2O) d点所示的溶液中,c(NH4+)=2c(SO ) NH3·H2O的电离常数Kb=1.0×10-4
) NH3·H2O的电离常数Kb=1.0×10-4
滴加过程中当溶液呈中性时,V(NaOH)>20mL 当V(NaOH)=30mL时,则有:2c(Na+)=3c(A2-)+3c(HA-) H2A在水中的电离方程式是:H2A.=H++HA-;HA-  H++A2- 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(0H-)
H++A2- 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(0H-) 
当V(NaOH)=20 mL时,溶液中离子浓度大小关系: c(HA-) > c(Na+) > c(A2-) > c(H+) >c(OH-) 等浓度的NaOH溶液与H2A溶液按2:1混合后, 其溶液中水的电离程度比纯水大 NaHA溶液中:c(OH—)=c(H+)+c(HA–)+2c(H2A.) 向上述加入20mLNaOH溶液后所得溶液中再加入水的过程中,pH可能减小
M.点溶液中:2c(HA-)+c(A2-)=0.2 mol/L N.点溶液呈酸性,则c(Na+) < 3c(HA-) 若N.点溶液pH =4.2,则Ka2(H2A.)的数量级为10−4 V(NaOH)=20mL时,溶液中:c(H+) < c(OH-)

 H++A2- 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-) 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 0.0l mol·L-l的NaHA溶液pH>2
H++A2- 常温下,NH4HA溶液中滴加NaOH溶液至溶液pH=7,则c(Na+) = 2c(A2-) 相同条件下,体积相等、pH相等的盐酸与H2A溶液中和NaOH的量相等 0.0l mol·L-l的NaHA溶液pH>2
 c(HClO)+c(ClO-)=c(HCO3-) +c(H2CO3)
c(HClO)+c(ClO-)=c(HCO3-) +c(H2CO3) 常温下,NH4Cl溶液加水稀释, 不变 向硅酸钠溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解 如图可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
常温下,NH4Cl溶液加水稀释, 不变 向硅酸钠溶液中滴加酚酞,溶液变红,证明Na2SiO3发生了水解 如图可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化

 A.H2A在水中的电离方程式是:H2A===H++HA-、HA-
A.H2A在水中的电离方程式是:H2A===H++HA-、HA- H++A.2- 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-) 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)> c(OH-)
H++A.2- 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 当V(NaOH)=30 mL时,溶液中存在以下关系:2c(H+)+c(HA-)+2c(H2A)=c(A2-)+2c(OH-) 当V(NaOH)=20 mL时,溶液中各粒子浓度的大小顺序为c(Na+)>c(HA-)>c(H+)> c(OH-)
 将减小
将减小

 ) NH3·H2O的电离常数Kb=1.0×10-4
) NH3·H2O的电离常数Kb=1.0×10-4
 H++A2- 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(0H-)
H++A2- 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(0H-) 