你可能感兴趣的试题
此电池的正极为Ni2O3、负极为Al,电池中的凝胶呈碱性。 电池放电时,负极反应为Al + 3OH- - 3e-= Al(OH)3 电池充电过程中,阴极附近溶液的pH升高 电池充电时,阴极反应为2Ni(OH)2 + 2OH- - 2e- = Ni2O3 + 3H2O
纯水中 0.10molL-1LHAc溶液中 0.10molL-1NH3•H2O溶液中 0.10molL-1MgCl2溶液中
无色透明溶液中:Al3+、Ca2+、Cl-、HCO3-。 含大量Fe3+的溶液中:K+、I-、SO42-、NO3-。 与Al反应放出H2的溶液中:NH4+、Na+、NO3-、F.- 。 由水电离出的c(H+) = 1.0×10-14mol/L的溶液中:Mg2+、K+、Cl-、SO42-。
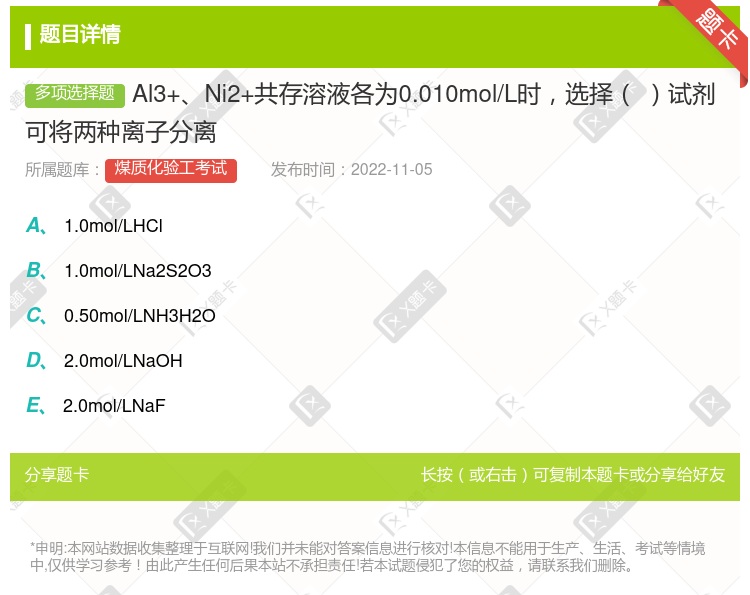
1.0mol/LHCl 0.50mol/LH2SO4 0.50mol/LNH3H2O 2.0mol/LNaOH 0.02mol/LEDTA
1 molL -1 0.5 molL -1 .0.6 molL -1 0.4 molL -1
2molL-1 1.25molL-1 1molL-1 2.5molL-1
10℃20mL3 molL﹣1的X溶液 20℃30 mL 2 molL﹣1的X溶液 20℃10 mL 4 molL﹣1的X溶液 10℃10 mL 2 molL﹣1的X溶液
在0.1 mol/LNa2CO3溶液中:Al3+、NH4+、SO42-、NO3-一定能大量共存 常温下, =0.1 mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3- 清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s)+CO32-(aq)
=0.1 mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3- 清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s)+CO32-(aq)  SO42-(aq)+CaCO3(s) 向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-+Al3++3OH-=BaSO4↓+Al(OH)3↓
SO42-(aq)+CaCO3(s) 向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-+Al3++3OH-=BaSO4↓+Al(OH)3↓
Al Ni Cu Ni Al Cu Cu Ni Al Al Cu Ni
2molL-1 1.25molL-1 1molL-1 2.5molL-1
使甲基橙呈红色的溶液中:Na+、[Al(OH)4]﹣、NO3﹣、CO32﹣ 由水电离产生的c(H+)=10﹣12molL﹣1的溶液:NH4+、SO42﹣、HCO3﹣、Cl﹣ 含有0.1 molL﹣1 HCO3﹣的溶液:Na+、Fe3+、NO3﹣、SCN﹣ 
 =0.1 molL﹣1的溶液:Na+、K+、CO32﹣、NO3﹣
=0.1 molL﹣1的溶液:Na+、K+、CO32﹣、NO3﹣
pH=7的溶液中:K.+、Fe3+、Cl-、NO3— 强酸性溶液中:Cu2+、ClO-、Cl-、Ba2+ 0.1 mol·L-1 的NaHCO3溶液中:K.+、Al3+、Fe3+、NO3— 由水电离出的c(H+)=10-13 mol·L-1的溶液中:Al3+、K.+、NO3—、SO42—
当铝、锌离子共存时,可用NH4F掩蔽Zn2+,而测定Al3+ 测定钙、镁时,可用三乙醇胺掩蔽少量Fe3+、Al3+ Bi3+、Fe2+共存时,可用盐酸羟胺掩蔽Fe3+的干扰 钙、镁离子共存时,可用NaOH掩蔽Mg2+
3molL -1 氨水的浓度不够大,溶液的碱性不够强 NaF溶液碱性较强,Al 3+ 完全反应生成AlO 2 - ,而AlO 2 - 不能与氨水反应生成Al(OH) 3 氨水为弱碱溶液,Al 3+ 不与弱碱反应 Al 3+ 与F.- 结合生成新物质,溶液中几乎没有Al 3+
原混合溶液中c(Fe3+):c(Al3+)=1:1 Fe(NO3)3溶液中混有杂质Al(NO3)3可以加入过量的NaOH溶液除去 B.点两种沉淀共存,此时上层溶液中c(Al3+):c(Fe3+)=2.5×104 C.点溶液中的溶质只有NaAlO2
 =0.1 mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3- 清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s)+CO32-(aq)
=0.1 mol/L的溶液中,下列离子一定能大量共存:K+、Cl-、Fe2+、NO3- 清洗锅炉时先用纯碱溶液浸泡的主要原因:CaSO4(s)+CO32-(aq)  SO42-(aq)+CaCO3(s) 向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-+Al3++3OH-=BaSO4↓+Al(OH)3↓
SO42-(aq)+CaCO3(s) 向Al2(SO4)3溶液中加入少量Ba(OH)2溶液:Ba2++SO42-+Al3++3OH-=BaSO4↓+Al(OH)3↓

 =0.1 molL﹣1的溶液:Na+、K+、CO32﹣、NO3﹣
=0.1 molL﹣1的溶液:Na+、K+、CO32﹣、NO3﹣