你可能感兴趣的试题
原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大 此电池工作原理与硅太阳能电池工作原理相同 Fe为正极,石墨上发生的反应为:2H++2e-=H2↑ 若装置中的盐桥用铁丝代替,电流表指针无偏转 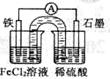
反应中,盐桥中的K+会移向CuSO4溶液
取出盐桥后,电流计依然发生偏转
铜片上有气泡逸出
反应前后铜片质量不改变
反应中,盐桥中的K+会移向CuSO4溶液
取出盐桥后,电流计依然发生偏转
铜片上有气泡逸出
反应前后铜片质量不改变
反应开始时,乙中石墨电极为负极 可用含琼胶的KCl饱和溶液做盐桥,放电时,Cl-向左移动 电流计读数为零时,反应达到化学平衡状态 电流计读数为零后,在甲中溶入FeCl2固体,电流计指针与原来偏转方向相反
CaO+H2O== Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能 某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁作负极,铜作正极 理论上说,任何能自发进行的氧化还原反应都可设计成原电池
反应中,盐桥中的K+会移向CuSO4溶液 取出盐桥后,电流计依然发生偏转 铜片上有气泡逸出 反应前后铜片质量不改变
KCl饱和溶液中不能再溶解其他物质 20 ℃时,100 g KCl饱和溶液中含KCl 34.0 g 40 ℃时,KCl饱和溶液的质量分数为40.0% 60 ℃的KCl饱和溶液降温至20 ℃,有晶体析出
铜片上有气泡逸出
取出盐桥后,电流计依然发生偏转
反应中,盐桥中的K+会移向CuSO4溶液
反应前后铜片质量不改变
反应中,盐桥中的K+会移向CuSO4溶液
取出盐桥后,电流计依然发生偏转
铜片上有气泡逸出
反应前后铜片质量不改变
铜片上有气泡逸出
取出盐桥后,电流计依然发生偏转
反应前后铜片质量不改变
反应中,盐桥中的K+会移向CuSO4溶液
KCI饱和溶液中不能再溶解其他物质 20℃时,100 g KCl饱和溶液中含KCI 34.0 g 40℃时,KCl饱和溶液的质量分数为40.0% 60℃的KCl饱和溶液降温至20℃,有晶体析出
电解质溶液导电是化学变化,金属导电是物理变化 某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液 因为镁的活泼性强于铝,所以将镁、铝用导线连接后放入氢氧化钠溶液中,镁作负极、铝作正极 不能自发进行的氧化还原反应,任何方法都不可以实现
CaO+H2O===Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的 化学能转化为电能 某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液 原电池的两极一定是由活动性不同的两种金属组成 从理论上讲,任何能自发进行的氧化还原反应都可设计成原电池
反应中,盐桥中的K.+会移向CuSO4溶液 取出盐桥后,电流计依然发生偏转 铜片上有气泡逸出 反应前后铜片质量不改变
盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用 饱和KCl琼脂溶液 理论上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池 此过程中H.+得电子,发生氧化反应 电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中
饱和KCl琼脂溶液 理论上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池 此过程中H.+得电子,发生氧化反应 电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中
盐桥中的K+ 移向AgNO3溶液 负极反应为:Ag –e— =Ag+ 该装置可将电能转化为化学能 在外电路中,电子由银电极流向铜电极
该电池工作时,铜片上有气泡逸出 取出盐桥后,电流表依然发生偏转 反应中,盐桥中的K+会移向CuSO4溶液 反应前后铜片质量不改变
原电池工作一段时间后,FeCl2溶液中c(Cl-)会增大 Fe为负极,发生的反应为:Fe — 3e- = Fe3+ Fe为正极,石墨上发生的反应为:2H++2e-===H2↑ 原电池装置中的盐桥完全可用金属导线代替 
铜片上有气泡逸出 取出盐桥后,检流计依然发生偏转 反应中,盐桥中的K.+会移向CuSO4溶液 反应前后铜片质量不改变
铜片上有气泡逸出 取出盐桥后,电流计依然发生偏转 反应中,盐桥中的K+会移向CuSO4溶液 反应前后铜片质量不改变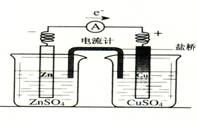



 饱和KCl琼脂溶液 理论上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池 此过程中H.+得电子,发生氧化反应 电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中
饱和KCl琼脂溶液 理论上1molCr溶解,盐桥中将有2molCl-进入左池,2molK+进入右池 此过程中H.+得电子,发生氧化反应 电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中

