





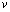 沿垂直于电场方向射入平行板之间,则带电粒子在电场区域内运动的轨迹是(设负极板 固定不动,带电粒子始终不与极板相碰) ( )A.直线 B.正弦曲线 抛物线 向着电场力方向偏转且加速度作周期性变化的曲线
沿垂直于电场方向射入平行板之间,则带电粒子在电场区域内运动的轨迹是(设负极板 固定不动,带电粒子始终不与极板相碰) ( )A.直线 B.正弦曲线 抛物线 向着电场力方向偏转且加速度作周期性变化的曲线

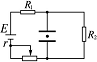





 沿垂直于电场方向射入平行板之间,则带电粒子在电场区域内运动的轨迹是(设负极板 固定不动,带电粒子始终不与极板相碰) A.直线 B.正弦曲线 抛物线 向着电场力方向偏转且加速度作周期性变化的曲线
沿垂直于电场方向射入平行板之间,则带电粒子在电场区域内运动的轨迹是(设负极板 固定不动,带电粒子始终不与极板相碰) A.直线 B.正弦曲线 抛物线 向着电场力方向偏转且加速度作周期性变化的曲线 
 沿垂直于电场方向射入平行板之间,则带电粒子在电场区域内运动的轨迹是(设负极板 固定不动,带电粒子始终不与极板相碰)( )A.直线 B.正弦曲线 抛物线 向着电场力方向偏转且加速度作周期性变化的曲线
沿垂直于电场方向射入平行板之间,则带电粒子在电场区域内运动的轨迹是(设负极板 固定不动,带电粒子始终不与极板相碰)( )A.直线 B.正弦曲线 抛物线 向着电场力方向偏转且加速度作周期性变化的曲线
