你可能感兴趣的试题
将容器容积变为20 L,Z的新平衡浓度将等于原平衡浓度的一半 若温度和体积不变,往容器内增加1 molY.,Y.的转化率将增大 60 s时Z.的平衡浓度为0.03mol/L. 若升高温度,X.的体积分数增大,则正反应的△H>0
刚开始反应时速率:甲>乙 平衡后反应放热:甲>乙 500℃下该反应平衡常数:K=3×102 若a≠0,则0.9
Q1>Q3>Q2 =78.8kJ 三个容器中反应的平衡常数均为K=2 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50% 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=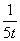 mol/(L.·min)
mol/(L.·min)
通入2L.容积恒定的密闭容器甲中,若维持容器内温度不变,5 min末测得A.的物质的量为0.8 mol。用 的浓度变化来表示该反应的速率为
A.0.24 mol/(L·min) B.0.08mol/(L·min)
0.06 mol/(L·min) 0.12mol/(L·min)
60 s内X.的平均反应速率为0.01 mol·L-1·s-1 升高温度,若X.的体积分数减小,则正反应的△H.<0 将容器的容积变为20L.,达平衡后Z.的浓度为0.015 mol·L-1 保持温度和体积不变,若再充入1 molX.,Y.的转化率将增大
通入2L.容积恒定的密闭容器甲中,若维持容器内温度不变,5 min末测得A.的物质的量为0.8 mol。用C.的浓度变化来表示该反应的速率为 A. 0.24 mol/(L.·min) 0.12 mol/(L.·min) 0.08 mol/(L.·min) 0.06 mol/(L.·min)
B.C.三种气体,保持一定温度,在t1~t4时刻测得A. C.三种物质的物质的量如下表。据此判断下列结论中不正确的是( ) A.在容器中发生的反应为:2A+B C B.平衡时A.的转化率比B.的转化率高 在该温度下该反应的化学平衡常数K.=200 在t1~t2内C.物质的平均反应速率为[2/(t2 -t1)]mol/(L·s)
C B.平衡时A.的转化率比B.的转化率高 在该温度下该反应的化学平衡常数K.=200 在t1~t2内C.物质的平均反应速率为[2/(t2 -t1)]mol/(L·s)
以X.浓度变化表示的反应速率为0.001mol/(L·s) 将容器容积变为20L,Z.的平衡浓度为原来的 若增大压强,则正反应速率增大,逆反应速率减小 若升高温度,X.的体积分数增大,则该反应的△H>0
若增大压强,则正反应速率增大,逆反应速率减小 若升高温度,X.的体积分数增大,则该反应的△H>0
通入2L.容积恒定的密闭容器甲中,若维持容器内温度不变,5 min末测得A.的物质的量为0.8 mol。用 的浓度变化来表示该反应的速率为
A.0.24 mol/(L·min) B.0.08mol/(L·min)
0.06 mol/(L·min) 0.12mol/(L·min)
刚开始反应时速率:甲>乙 平衡后反应放热:甲>乙 500℃下该反应平衡常数:K=3×102 若a≠0,则0.9
60 s时Z.的平衡浓度为0.03 mol/L 将容器容积变为20L.,Z.的新平衡浓度将等于原平衡浓度的一半 若温度和体积不变,往容器内增加1 molY.,Y.的转化率将增大 若升高温度,X.的体积分数增大,则正反应的△H.> 0

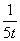 mol/(L.·min)
mol/(L.·min)
 C B.平衡时A.的转化率比B.的转化率高 在该温度下该反应的化学平衡常数K.=200 在t1~t2内C.物质的平均反应速率为[2/(t2 -t1)]mol/(L·s)
C B.平衡时A.的转化率比B.的转化率高 在该温度下该反应的化学平衡常数K.=200 在t1~t2内C.物质的平均反应速率为[2/(t2 -t1)]mol/(L·s)
 若增大压强,则正反应速率增大,逆反应速率减小 若升高温度,X.的体积分数增大,则该反应的△H>0
若增大压强,则正反应速率增大,逆反应速率减小 若升高温度,X.的体积分数增大,则该反应的△H>0