你可能感兴趣的试题
常温下,pH均为3的醋酸和硫酸铝两种溶液中,由水电离出的氢离子浓度之比为1∶108 25 ℃时0.1mol•L-1NH4Cl溶液的K.W.大于100 ℃时0.1mol•L-1NaCl溶液的K.W. 根据溶液的pH与酸碱性的关系,推出pH=6.5的溶液一定显酸性 室温下,将pH=2的盐酸与pH=12的氨水等体积混合,溶液显中性
室温下,浓度均为0.05mol/L的NaOH溶液和HCl溶液,以3∶2体积比相混合,所得溶液的pH等于12 室温下,将稀氨水逐滴加入稀硫酸中,当溶液的pH=7时,2c(SO42-)>c(NH4+) 室温下,0.1mol/L的盐酸和0.1mol/L的氢氧化钡等体积混合,混合后溶液pH=7 室温下,pH=4的醋酸溶液和pH=10的氢氧化钠溶液等体积混合后的溶液pH>7
c(NH4+)=c(Cl-)的NH4Cl溶液 c(H+)=1.0×10-7mol/L 的溶液 室温下,将pH=3 的酸与pH=11的碱溶液等体积混合后的溶液 室温下,用标准浓度的盐酸滴定未知浓度的氢氧化钠溶液,以酚酞为指示剂达滴定终点时的溶液
浓度均为0.1 mol/L的氨水与盐酸等体积混合后的溶液中:c(H+)=c(OH-)+c(NH3·H2O) 浓度均为0.1 mol/L的CH3COOH与CH3COONa溶液等体积混合后溶液显酸性,则c(CH3COO-)3COOH) 浓度均为0.1 mol/L的小苏打溶液和氢氧化钠溶液等体积混合: c(Na+)+c(H+)=c(CO32-)+c(OH-)+c(HCO3-) 室温下,用pH=3的HCl溶液滴定10 mL pH=11的氨水,达到滴定终点时用去盐酸的体积为10 mL
0.1912molL-1 0.2302molL-1 0.1098molL-1 0.1789molL-1
1 molL -1 0.5 molL -1 .0.6 molL -1 0.4 molL -1
pH=12的氨水溶液与pH=2的盐酸溶液等体积混合 浓度均为0.1 mol/L.的硫酸氢铵溶液和氢氧化钠溶液等体积混合
浓度均为0.1 mol/L.的硫酸氢铵溶液和氢氧化钠溶液等体积混合 浓度均为0.1 mol/L.的小苏打溶液和氢氧化钠溶液等体积混合
浓度均为0.1 mol/L.的小苏打溶液和氢氧化钠溶液等体积混合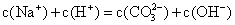 浓度均为0.1 mol/L.的醋酸溶液和氢氧化钠溶液等体积混合
浓度均为0.1 mol/L.的醋酸溶液和氢氧化钠溶液等体积混合 
该一元碱溶液浓度为0.100 0 mol·L-1 a、b、c点的水溶液导电性依次增强 室温下,MOH的电离常数K.b=1×10-5 b点:c(M+)+c(MOH)=c(Clˉ) 
2molL-1 1.25molL-1 1molL-1 2.5molL-1
10℃20mL3 molL﹣1的X溶液 20℃30 mL 2 molL﹣1的X溶液 20℃10 mL 4 molL﹣1的X溶液 10℃10 mL 2 molL﹣1的X溶液
甲酸(Ka=1.80×10^-4 ) H 2 S (K a =8.9×10^-8 ) H 3 BO 3 (Ka=7.30×10 -10 ) HCN(K a =8.9×10^- 10 ) HBrO (K a =3.0×10^-9 )
均为0.84L 均为0.56L (1)>(2) (2)>(1)
物质的量浓度均为0.1mol/L,3种溶液pH的大小顺序是③>②>① 物质的量浓度均为0.1 mol/L,将3种溶液稀释相同倍数,pH变化最大的是② 物质的量浓度均为0.1mol/L,分别加入25mL 0.1mol/L盐酸后,pH最大的是① pH均为9时,3种溶液的物质的量浓度的大小顺序是③>①>②
将溶液稀释到原体积的2倍 加入适量的醋酸钠固体 加入等体积0.2 molL﹣1盐酸 加少量冰醋酸
2molL-1 1.25molL-1 1molL-1 2.5molL-1
两种溶液中的c(Na+)相等 两溶液中由水电离出的c(OH-)之比为10-9/10-5 分别加水稀释到100mL时,两种溶液的pH依然相等 分别与同浓度的盐酸反应,恰好反应时消耗的盐酸体积相等
3molL -1 氨水的浓度不够大,溶液的碱性不够强 NaF溶液碱性较强,Al 3+ 完全反应生成AlO 2 - ,而AlO 2 - 不能与氨水反应生成Al(OH) 3 氨水为弱碱溶液,Al 3+ 不与弱碱反应 Al 3+ 与F.- 结合生成新物质,溶液中几乎没有Al 3+

 浓度均为0.1 mol/L.的硫酸氢铵溶液和氢氧化钠溶液等体积混合
浓度均为0.1 mol/L.的硫酸氢铵溶液和氢氧化钠溶液等体积混合 浓度均为0.1 mol/L.的小苏打溶液和氢氧化钠溶液等体积混合
浓度均为0.1 mol/L.的小苏打溶液和氢氧化钠溶液等体积混合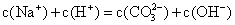 浓度均为0.1 mol/L.的醋酸溶液和氢氧化钠溶液等体积混合
浓度均为0.1 mol/L.的醋酸溶液和氢氧化钠溶液等体积混合 
