你可能感兴趣的试题
反应过程可表示为 E.1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 正反应的热效应为ΔH=E.1-E.2<0,所以正反应为放热反应 此图中逆反应的热效应ΔH=E.1-E.2<0,所以逆反应为放热反应
该反应为放热反应 催化剂能降低该反应的活化能 催化剂能改变该反应的焓变 逆反应的活化能大于正反应的活化能 
该反应为放热反应 催化剂能改变该反应的焓变 催化剂能降低该反应的活化能 逆反应的活化能大于正反应的活化能
该反应为放热反应 催化剂能改变该反应的焓变 催化剂能降低该反应的活化能 逆反应的活化能大于正反应的活化能
该反应为放热反应 催化剂能改变该反应的焓变 催化剂能降低该反应的活化能 逆反应的活化能大于正反应的活化能
(g)+ (g)  (g)+ (g)过程中的能量变化如图所示,由此可判断 A.1molA与1molB充分反应后,能量变化为ΔE B.加入催化剂后,反应加快,ΔE减小 C.反应物的总键能小于生成物的总键能 D.反应达到平衡时,升高温度,A.的转化率增大
(g)+ (g)过程中的能量变化如图所示,由此可判断 A.1molA与1molB充分反应后,能量变化为ΔE B.加入催化剂后,反应加快,ΔE减小 C.反应物的总键能小于生成物的总键能 D.反应达到平衡时,升高温度,A.的转化率增大 
反应过程可表示为A.+BC—→[A… … ] —→AB+C(反应物)(过渡态) (产物)B.此图中逆反应的热效应△H=E1—E2,为吸热反应C.正反应的热效应为△H=E1—E2,且E2>E1,所以正反应为放热反应 E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能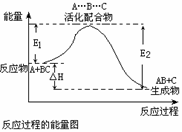
该反应的正反应为吸热反应 催化剂能改变反应的焓变 催化剂不能降低反应的活化能 逆反应的活化能大于正反应的活化能 
该反应的能量变化与氯化铵晶体和氢氧化钡晶体反应相同 该反应的ΔH= E1- E2 若生成物中某一物质由气态变成液态,则该反应的ΔH变大 加催化剂不能改变反应的ΔH,但可以加快反应速率
反应过程可表示为 A.+BC—→[A…B…C] —→AB+C (反应物) (过渡态) (产物) E1为反应物的平均能量与过渡态的能量差,称为正 反应的活化能 此图中正反应的热效应为△H=E1—E2,且E2>E1, 所以正反应为放热反应 此图中逆反应的热效应△H=E1—E2,为吸热反应
该反应为放热反应 催化剂能改变该反应的焓变 催化剂能降低该反应的活化能 逆反应的活化能大于正反应的活化能
反应过程可表示为 E.1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 正反应的热效应为ΔH=E.1-E.2<0,所以正反应为放热反应 此图中逆反应的热效应ΔH=E.1-E.2<0,所以逆反应为放热反应
该反应为放热反应 催化剂能改变该反应的焓变 催化剂能降低该反应的活化能 逆反应的活化能大于正反应的活化能
该反应过程中没有能量变化 该反应是吸热反应 相同条件下,金刚石比石墨稳定 相同质量的C.(石墨,s)比C.(金刚石,s)的能量高
反应过程可表示为A.+BC—→[A… … ] —→AB+C (反应物) (过渡态) (产物) B.E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 C.正反应的热效应为△H.=E1—E2,且E2>E1,所以正反应为放热反应 此图中逆反应的热效应△H.=E1—E2,为吸热反应 
该反应是吸热反应 反应物的总能量低于生成物的总能量 该反应的反应热△H. < 0 加入催化剂后反应放出的热会减少 
该反应为放热反应 催化剂能改变该反应的焓变 催化剂能降低该反应的活化能 逆反应的活化能大于正反应的活化能
催化剂能改变该反应的焓变 催化剂能降低该反应的活化能 逆反应的活化能大于正反应的活化能 该反应为放热反应
1 mo N2与3 mo H2反应可以放出92 kJ的热量 b曲线是加入催化剂时的能量变化曲线 加入催化剂,该反应的焓变减小 正反应的活化能等于逆反应的活化能 
(g)+ (g)  (g)+ (g)过程中的能量变化如图所示,由此可判断( ) A.1molA与1molB充分反应后,能量变化为ΔE B.加入催化剂后,反应加快,ΔE减小 C.反应物的总键能小于生成物的总键能 D.反应达到平衡时,升高温度,A.的转化率增大
(g)+ (g)过程中的能量变化如图所示,由此可判断( ) A.1molA与1molB充分反应后,能量变化为ΔE B.加入催化剂后,反应加快,ΔE减小 C.反应物的总键能小于生成物的总键能 D.反应达到平衡时,升高温度,A.的转化率增大


 (g)+ (g)过程中的能量变化如图所示,由此可判断 A.1molA与1molB充分反应后,能量变化为ΔE B.加入催化剂后,反应加快,ΔE减小 C.反应物的总键能小于生成物的总键能 D.反应达到平衡时,升高温度,A.的转化率增大
(g)+ (g)过程中的能量变化如图所示,由此可判断 A.1molA与1molB充分反应后,能量变化为ΔE B.加入催化剂后,反应加快,ΔE减小 C.反应物的总键能小于生成物的总键能 D.反应达到平衡时,升高温度,A.的转化率增大 






 (g)+ (g)过程中的能量变化如图所示,由此可判断( ) A.1molA与1molB充分反应后,能量变化为ΔE B.加入催化剂后,反应加快,ΔE减小 C.反应物的总键能小于生成物的总键能 D.反应达到平衡时,升高温度,A.的转化率增大
(g)+ (g)过程中的能量变化如图所示,由此可判断( ) A.1molA与1molB充分反应后,能量变化为ΔE B.加入催化剂后,反应加快,ΔE减小 C.反应物的总键能小于生成物的总键能 D.反应达到平衡时,升高温度,A.的转化率增大