你可能感兴趣的试题
Ⅰ期临床试验 Ⅱ期临床试验 Ⅲ期临床试验 Ⅳ期临床试验 生物等效性试验
Ⅰ期临床试验 Ⅱ期临床试验 Ⅲ期临床试验 Ⅳ期临床试验
Ⅰ期临床试验 Ⅱ期临床试验 Ⅲ期临床试验 Ⅳ期临床试验 生物等效性试验
Ⅰ期临床试验 Ⅱ期临床试验 Ⅲ期临床试验 Ⅳ期临床试验
I期临床试验 Ⅱ期临床试验 Ⅲ期临床试验 Ⅳ期临床试验
考察广泛使用条件下药物的罕见不良反应 确定不同患者人群的剂量方案 评价特殊人群中使用的受益-风险比 改进给药剂量 发现新的适应证
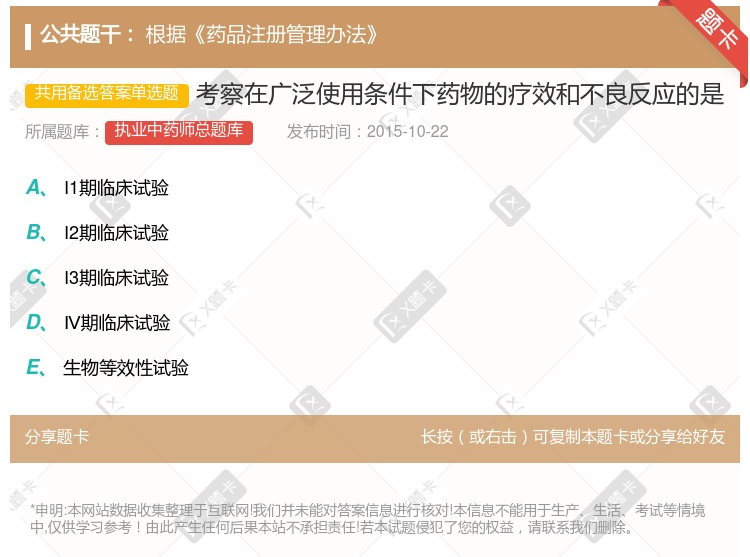
I期临床试验 I2期临床试验 I3期临床试验 Ⅳ期临床试验 生物等效性试验(分隔符)根据《药品注册管理办法》
I1期临床试验 I2期临床试验 I3期临床试验 Ⅳ期临床试验 Ⅴ期临床试验
为药物注册申请提供充分依据 验证药物对目标适应证患者的治疗作用和安全性 考察在广泛使用条件下的药物的疗效的不良反应 考察在广泛使用条件下的药物的疗效和不良反应,评价在普通或者特殊人群中使用的利益与风险关系,改进给药剂量 评价在普通或者特殊人群中使用的利益与风险关系
为药物注册申请提供充分依据 考察在广泛使用条件下的药物的疗效及不良反应 验证药物对目标适应证患者的治疗作用和安全性 考察在广泛使用条件下的药物的疗效和不良反应,评价在普通或者特殊人群中使用的利益与风险关系,改进给药剂量 评价在普通或者特殊人群中使用的利益与风险关系
Ⅰ期临床试验 Ⅱ期临床试验 Ⅲ期临床试验 Ⅳ期临床试验 生物等效性试验
改进剂量 评价药品利益与风险关系 验证药物的治疗作用和安全性 观察联合用药的不良反应及药物相互作用 在广泛使用条件下考察药品疗效和不良反应
按经销、使用假药处罚 按销售劣药处理 处以警告或并处2万至3万元罚款 处以警告或并处罚款 按无证经营处罚
按经销、使用假药处罚 按销售劣药处理 处以警告或并处2万至3万元罚款 处以警告或并处罚款 按无证经营处罚
临床前研究 I 期临床试验 II 期临床试验 IV 期临床试验
新药申请 药物的临床研究 Ⅲ期临床试验 Ⅳ期临床试验 Ⅰ期临床试验
Ⅰ期临床试验 Ⅱ期临床试验 Ⅲ期临床试验 Ⅳ期临床试验
Ⅰ期临床试验 Ⅱ期临床试验 Ⅲ期临床试验 Ⅳ期临床试验 Ⅴ期临床试验
I期临床试验 Ⅱ期临床试验 Ⅲ期临床试验 Ⅳ期临床试验 生物等效性试验
改进给药剂量 考察广泛使用条件下药物的罕见不良反应 评价特殊人群中使用的受益-风险比 确定不同患者人群的剂量方案 发现新的适应证