你可能感兴趣的试题
同周期中,丁的最高价氧化物对应水化物的酸性最强 气态氢化物的稳定性:丙>丁 丙的氧化物能与戊的氢化物的水溶液能反应 原子半径大小:甲<丙,且甲有多种气态氢化物
Y.、Z.的阴离子核外电子数之差为18 常压下,Y.单质的沸点比Z.单质的沸点低 W.的氢化物的稳定性比X.的氢化物的稳定性强 Y.元素的非金属性比W.元素的非金属性强
都能生成+6价化合物 原子的最外层电子数都是6 都能生成稳定的氢化物 单质在通常情况下均为固体
常压下五种元素的单质中W.单质的沸点最高 Z.的氢化物比Y.的氢化物稳定 W.元素最高价氧化物的水化物酸性比Z.元素的强 Z.、W.的阴离子电子层结构与R.原子的相同
胶体产生丁达尔效应是由胶粒的大小决定的
同一主族元素的氢化物,相对分子质量越大,它的沸点一定越高
分子晶体溶于水时,一定不破坏共价键
具有相同质子数和电子数的粒子中,可能是一种原子和一种离子
YO2能使紫色石蕊试液先变红后褪色 将W.的氧化物溶于水可得W.的含氧酸 X的氢化物沸点比W.的氢化物的沸点高 Y的阴离子电子层结构与Z.原子的相同
稳定性:H2S>HF HCl的电子式为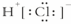
一个D2O分子所含的中子数为8 在卤化氢中HF最稳定
常压下五种元素的单质中W.单质的沸点最高 Z.的氢化物比Y.的氢化物稳定 W.元素最高价氧化物的水化物酸性比Z.元素的强 Z.、W.的阴离子电子层结构与R.原子的相同
同主族元素从上到下,非金属性逐渐增强 元素的最高正化合价均等于它所在的族序数 同周期的主族元素的原子半径越小,越难失去电子 第ⅤA.族元素的氢化物的沸点,从上到下依次逐渐升高
族元素.下列对砷及其化合物的叙述中,正确的是 A.砷的原子半径大于磷的原子半径 砷的气态氢化物比磷的气态氢化物稳定 单质砷很容易跟氢气反应生成相应的气态氢化物 砷酸的酸性比磷酸的酸性强
稳定性:H2S>HCl HCl的电子式为: 一个D2O分子所含的中子数为8 卤化氢中,HF的还原性最弱
一个D2O分子所含的中子数为8 卤化氢中,HF的还原性最弱
.D.在过量的 中燃烧的主要产物为DB3 B.. 的氢化物的水溶液酸性比E.的氢化物的酸性强 C.. 与B.形成的阴离子可能有DB32﹣、D.2B42﹣ D..E.-的半径大于D.2-的半径
稳定性:H2S>HF HCl的电子式为 一个D2O分子所含的中子数为8 在卤化氢中HF最稳定
一个D2O分子所含的中子数为8 在卤化氢中HF最稳定
从左向右数第七纵行是ⅦA族 从左向右数第十一纵行是ⅠB族 ⅠA族全部是金属元素 第ⅦA族元素从上到下,其氢化物的稳定性逐渐增强
Z一定是活泼的金属元素 Y的氢化物很不稳定 X的单质性质很活泼 Y的氢化物稳定性大于Z的氢化物稳定性
B.C.原子序数依次递增,它们的原子最外层电子数之和为10。A.与C.在周期表中同主族, 原子最外层电子数等于A.原子次外层电子数。下列有关叙述正确的是 ( ) A.原子半径A的氢化物 C.B.与C.的单质都可与烧碱溶液反应 B.单质在一定条件下能与A.的氧化物剧烈反应
常压下五种元素的单质中,Z单质为液态
Y、Z的阴离子的电子层结构都与R原子的相同
W的氢化物比X的氢化物稳定
W元素的电负性比Y元素的电负性强
S.原子的电子层数比Cl原子的电子层数多 Cl的氢化物的沸点比S.的氢化物沸点低 Cl的气态氢化物比S.的气态氢化物稳定 CI的失电子能力比S.强
B.C.的原子序数依次增大,其原子的最外层电子数之和为10,A.与C.在周期表中位置上下相邻, 原子最外层电子数等于A.原子次外层电子数,下列有关叙述不正确的是( ▲ ) A.A.与 可形成共价化合物 B.A.的氢化物的稳定性大于C.的氢化物的稳定性 C.原子半径A.<B.<C B.的氧化物的熔点比A.的氧化物的熔点高

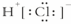
 一个D2O分子所含的中子数为8 卤化氢中,HF的还原性最弱
一个D2O分子所含的中子数为8 卤化氢中,HF的还原性最弱
 一个D2O分子所含的中子数为8 在卤化氢中HF最稳定
一个D2O分子所含的中子数为8 在卤化氢中HF最稳定