你可能感兴趣的试题
c(H+)>c(OH)>c(B+)>cA. c(B+)>cA.>c(H+)>c(OH) cA.>c(B+)>c(H+)>c(OH) c(B+)=cA.>c(H+)=c(OH)
溶液中,不断通入HCl。H2A.HA-、A2-  在溶液中所占物质的量分数(
在溶液中所占物质的量分数(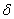 )与pOH[pOH=-lgc(OH-)]的关系如图所示,下列说法正确的是 A.H2A.的第二级电离平衡常数为10-10mol/L 随着HCl的通入
)与pOH[pOH=-lgc(OH-)]的关系如图所示,下列说法正确的是 A.H2A.的第二级电离平衡常数为10-10mol/L 随着HCl的通入 先减小后增大 当溶液呈中性时:c(Na+)=c(HA-)+2c(A2-) 将等浓度等体积的Na2A.与H2A.溶液混合后,溶液显碱性
先减小后增大 当溶液呈中性时:c(Na+)=c(HA-)+2c(A2-) 将等浓度等体积的Na2A.与H2A.溶液混合后,溶液显碱性
常温下,测得醋酸钠溶液的pH>7 常温下,测得0.1mol/L醋酸溶液的pH=4 常温下,将pH=1的醋酸溶液稀释1000倍,测得pH<4 常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和
c(H+)=1×10-7mol·L-1的溶液 水电离的H.+和OH-浓度相等的溶液 pH+pOH=14的溶液 pH=pOH的溶液
c(H+)=1×10-7mol/L的溶液 pH=pOH的溶液 〔提示:pOH=-lgc(OH-)〕 pH=14-pOH 的溶液 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
c(H+)=1×10-7 mol∙L-1的溶液 pH=pOH的溶液 pH=14-pOH的溶液 pOH=0的溶液
此温度下,水的离子积常数为1.0×10-2a M、N.两点所示的溶液中,水的电离程度相同 Q 点消耗的NaOH 溶液的体积等于HA 洛液的体积 N点溶液D.水稀释,C.(A-)/C(HA )减小
此温度下,水的离子积常数为1.0×10-2a M、N.两点所示的溶液中,水的电离程度相同 Q 点消耗的NaOH 溶液的体积等于HA 洛液的体积 N点溶液D.水稀释,C.(A-)/C(HA )减小
-,下列叙述不正确的是 A. 溶液中离子浓度的关系满足:c(H+)= c(OH-)+ c(A-) 0.10 mol/L的HA溶液中加水稀释,溶液中c(OH-)增大 HA溶液中加少量的NaA固体,平衡逆向移动 常温下,加入NaA固体可使HA的电离常数变小
常温下,pH相同的NaOH溶液和Ba(OH)2溶液中,水的电离程度相同 常温下,将pH=3的硫酸和pH=11的氨水等体积混合后,所得溶液的pH>7 常温下,将醋酸溶液与NaOH 溶液等体积混合后,若所得溶液的pH=7,则原溶液中c(CH3COOH)>c(NaOH) 常温下,pH=1的NaHSO4溶液:c(H+)=2c(SO42-)+c(OH-)
c(Na+) + c(H+) = c(HX-) + 2c(X2-) c(H+)·c(OH-) = 10-14 mol2·L-2 c(Na+) = c(X2-) + c(HX-) 溶液中pH = 1
N点处pH>pOH,则N点处所示溶液呈酸性 该温度下水的离子积K.w=1×10−2a Q点所示溶液呈中性,则M、N、Q三点中只有Q点溶液 中水的电离出的c(H+)与水的电离c(OH−)相等 M点所示溶液的导电能力强于Q点
Q点消耗氨水溶液的体积等于HCl溶液的体积 M点所示溶液导电能力强于Q.点 M点和N.点所示溶液中水的电离程度相同 N点所示溶液中c(NH4+) > c(OH-)
某温度下,不论何种水溶液中c(H+)·c(OH-)乘积相等,即水的离子积是一个常数 醋酸钠和醋酸的混合液中若c(Na+)=c(CH3COO-),则溶液中c(H+)=c(OH-) 如果定义pOH=-lgc(OH-),则常温下某水溶液中的pOH和pH之和等于14 某水溶液由于条件的改变,如果氢离子浓度变小,则氢氧根离子浓度一定变大
c(H+)=1×10-7mol/L的溶液 pH=pOH的溶液 〔提示:pOH=-lgc(OH-)〕 pH=14-pOH 的溶液 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后形成的溶液

 在溶液中所占物质的量分数(
在溶液中所占物质的量分数(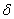 )与pOH[pOH=-lgc(OH-)]的关系如图所示,下列说法正确的是 A.H2A.的第二级电离平衡常数为10-10mol/L 随着HCl的通入
)与pOH[pOH=-lgc(OH-)]的关系如图所示,下列说法正确的是 A.H2A.的第二级电离平衡常数为10-10mol/L 随着HCl的通入 先减小后增大 当溶液呈中性时:c(Na+)=c(HA-)+2c(A2-) 将等浓度等体积的Na2A.与H2A.溶液混合后,溶液显碱性
先减小后增大 当溶液呈中性时:c(Na+)=c(HA-)+2c(A2-) 将等浓度等体积的Na2A.与H2A.溶液混合后,溶液显碱性