你可能感兴趣的试题
右图可表示由CO生成CO2的反应过程和能量关系
CO的燃烧热为283kJ/mol
2 Na2O2(s)+2 CO2(s)=2 Na2CO3(s)+O2(g) △H.>﹣452kJ/mol
CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为2NA
CO的标准燃烧热为283 kJ 下图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1 CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
CO的燃烧热为566 kJ/mol 右图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH.>-452 kJ/mol CO2(g)与Na2O2(s)反应放出452kJ热量时,电子转移的物 质的量为为2 mol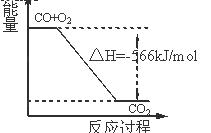
CO的燃烧热为283 kJ 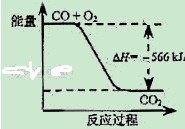 如图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
如图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
CuSO4+Mg = Cu+MgSO4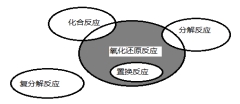
 2NaHCO3 Na2CO3+H2O+CO2↑ 2Na2O2+2CO2===2Na2CO3+O2 4Fe(OH)2+O2+2H2O===4Fe(OH)3
2NaHCO3 Na2CO3+H2O+CO2↑ 2Na2O2+2CO2===2Na2CO3+O2 4Fe(OH)2+O2+2H2O===4Fe(OH)3
CO的燃烧热为283 kJ 由CO生成CO2的反应过程是吸热反应 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH.>-452kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
CO的燃烧热为283 kJ 右图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH.< --452 kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为2×6.02×1023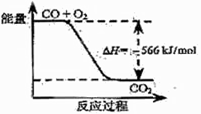
CO的燃烧热为283 kJ 右图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>—452 kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
CO的燃烧热为283kJ 右图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g) △H=—452kJ/mol CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023
CO的燃烧热为 283 kJ 反应①正反应活化能与逆反应活化能之差为+566 kJ/mol 反应 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol CO(g)与 Na2O2(s)反应放出 509 kJ 热量时,电子转移数为 6.02×1023
CO的燃烧热为283 kJ 如图可表示为CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH.>-452 kJ·mol-1 CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
CO的燃烧热为283 kJ 下图可表示由CO生成CO2的反应过程和能量关系  CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
CO的燃烧热为283 kJ 右图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH.>-452 kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.021023
CO的燃烧热ΔH= -566 kJ/mol CO的热值约为10.1kJ/g 2Na2O2(s) + 2CO2(s)= 2Na2CO3(s) + O2(g) ΔH.< -452 kJ/mol CO(g)与Na2O2(s)反应放出50.9 kJ热量时,电子转移为0.1mol


 如图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
如图可表示由CO生成CO2的反应过程和能量关系 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g)△H>﹣452 kJ/mol CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023

 2NaHCO3 Na2CO3+H2O+CO2↑ 2Na2O2+2CO2===2Na2CO3+O2 4Fe(OH)2+O2+2H2O===4Fe(OH)3
2NaHCO3 Na2CO3+H2O+CO2↑ 2Na2O2+2CO2===2Na2CO3+O2 4Fe(OH)2+O2+2H2O===4Fe(OH)3

 CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1