你可能感兴趣的试题
A.极为正极, 极为负极 B.电池内电解质溶液中所含的H+由B.极移向A.极 A.极的电极反应为:CH3COOH-8e-+2H2O====2CO2↑+8H+ 电池工作过程中,电解质溶液的pH会明显下降
该电池不适宜在过高或过低温度下使用 正极反应中有CO2生成 质子通过交换膜从负极区移向正极区 电池总反应为C6H12O6+ 6O2==6CO2 +6H2O
正极反应中有CO2生成 微生物促进了反应中电子的转移 质子通过交换膜从负极区移向正极区 电池总反应为C6H12O6+6O2=6CO2+6H2O
由于A. 两电极没有活动性差别,不能构成原电池 B.产物为无污染的水,属于环境友好的绿色电池 A.电极是负极,电极上发生氧化反应 外电路中电流由B.电极通过导线流向A.电极
A极电极反应式为: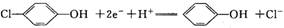 B.极电极反应式为:CH3COO--8e-+4H2O=2HCO3-+9H+ 溶液中的阴离子由A.极向B.极移动 该微生物电池在高温条件下无法正常工作1.
B.极电极反应式为:CH3COO--8e-+4H2O=2HCO3-+9H+ 溶液中的阴离子由A.极向B.极移动 该微生物电池在高温条件下无法正常工作1.
该电池不能够在高温下工作 电池的负极反应:C6H12O6+6H2O-24e-=6CO2↑+24H+ 放电过程中,H.+会从负极区向正极区迁移 在电池反应中,每消耗1 mol氧气,理论上能生成 标准状况下CO2气体 L.
L.
正极反应中有CO2生成 微生物促进了反应中电子的转移[学 质子通过交换膜从负极区移向正极区 电池总反应为C6H12O6+6O2=6CO2+6H2O
葡萄糖是还原剂 外电路中电子由A.极移向B.极 溶液中H+ 由B.极区移向A.极区 B.极电极反应式为:H2O2 +2H++2e-=== 2H2O
正极反应中有CO2生成 微生物促进了反应中电子的转移 质子通过交换膜从负极区移向正极区 电池总反应为C6H12O6+6O2=6CO2+6H2O
甲类微生物的代谢类型与乙类微生物酶代谢类型完全不同 甲和丙的活动可增加土壤肥力,而乙的活动会使土壤氮素丧失 参与丙过程的微生物,有的能独立完成该过程,有的则不能 丙类微生物一定只能在无氧环境中生存,因为相应过程不需要氧气
正极反应中有CO2生成 微生物促进了反应中电子的转移 质子通过交换膜从负极区移向正极区 电池总反应为C6H12O6+6O2═6CO2+6H2O
正极反应中有CO2生成 微生物促进了反应中电子的转移 质子通过交换膜从负极区移向正极区 电池总反应为C6H12O6+6O2===6CO2+6H2O
该原电池中,铜为正极 该原电池中,电子由铜片经过导线流入锌片 该原电池工作一段时间后,溶液的酸性减弱 该原电池工作一段时间后,锌片质量减小
X.极为微生物电池的负极 该电池能够在高温下工作 图中离子交换膜应为阴离子交换膜 Y.极电极反应式为:CH3COO--8e-+4H2O=2HCO3-+9H+
正极反应中有CO2生成 微生物促进了反应中电子的转移 质子通过交换膜从负极区移向正极区 电池总反应为C6H12O6+6O2===6CO2+6H2O
正极反应中有CO2生成 微生物促进了反应中电子的转移 质子通过交换膜从负极区移向正极区 电池总反应为C6H12O6+6O2===6CO2+6H2O
该电池不适宜在过高或过低温度下使用 正极反应中有CO2生成 质子通过交换膜从负极区移向正极区 电池总反应为C6H12O6+ 6O2==6CO2 +6H2O
B.相互关系示意图,下列叙述正确的是 A.若A.是HIV,则 最可能是B.细胞,此时B.细胞可释放抗体B.若A.B.是正在融合的动物细胞,则这项技术最重要的用途是培养杂种生物 若物质A.正在刺激微生物B.合成某种酶,则该过程属于酶活性调节 若物质A.是微生物B.合成并释放的,则A.最可能属于该微生物的次级代谢产物
A.若A.是HIV,则 最可能是B.细胞,此时B.细胞可释放抗体B.若A.B.是正在融合的动物细胞,则这项技术最重要的用途是培养杂种生物 若物质A.正在刺激微生物B.合成某种酶,则该过程属于酶活性调节 若物质A.是微生物B.合成并释放的,则A.最可能属于该微生物的次级代谢产物
正极反应中有CO2生成 微生物促进了反应中电子的转移 质子通过交换膜从负极区移向正极区 电池总反应为C6H12O6+6O2=6CO2+6H2O
A.电极是负极 外电路中电子由B.电极通过导线流向A.电极 产物为无污染的水,属于环境友好电池 该电池的总反应:2H2+O2===2H2O

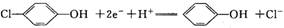 B.极电极反应式为:CH3COO--8e-+4H2O=2HCO3-+9H+ 溶液中的阴离子由A.极向B.极移动 该微生物电池在高温条件下无法正常工作1.
B.极电极反应式为:CH3COO--8e-+4H2O=2HCO3-+9H+ 溶液中的阴离子由A.极向B.极移动 该微生物电池在高温条件下无法正常工作1.
 L.
L.
 A.若A.是HIV,则 最可能是B.细胞,此时B.细胞可释放抗体B.若A.B.是正在融合的动物细胞,则这项技术最重要的用途是培养杂种生物 若物质A.正在刺激微生物B.合成某种酶,则该过程属于酶活性调节 若物质A.是微生物B.合成并释放的,则A.最可能属于该微生物的次级代谢产物
A.若A.是HIV,则 最可能是B.细胞,此时B.细胞可释放抗体B.若A.B.是正在融合的动物细胞,则这项技术最重要的用途是培养杂种生物 若物质A.正在刺激微生物B.合成某种酶,则该过程属于酶活性调节 若物质A.是微生物B.合成并释放的,则A.最可能属于该微生物的次级代谢产物