你可能感兴趣的试题
新平衡体系中,SO2和O2物质的量之比仍为2∶1 平衡向正反应方向移动,原因是正反应速率增大,逆反应速率减小 新平衡体系与旧平衡体系比较,SO3的浓度肯定增大 若所采取的措施是缩小容器的容积,则新旧平衡中SO2和O2的转化率之比都是1∶1
降压时,平衡常数增大 降温时,平衡常数增大 降压时,平衡常数减小 升温时,平衡常数增大
增大容器容积 通入大量O2 移去部分SO3 降低体系温度
降压时,平衡常数减小 降压时,平衡常数增大 降温时,平衡常数增大 升温时,平衡常数增大
SO2+Br2+2H2O===H2SO4+2HBr与2HBr+H2SO4(浓) Br2+SO2↑+2H2O互为可逆反应 既能向正反应方向进行,又能向逆反应方向进行的反应叫做可逆反应 在同一条件下,同时向正、逆两个方向进行的反应叫做可逆反应 电解水生成氢气和氧气与氢气和氧气点燃生成水的反应是可逆反应
Br2+SO2↑+2H2O互为可逆反应 既能向正反应方向进行,又能向逆反应方向进行的反应叫做可逆反应 在同一条件下,同时向正、逆两个方向进行的反应叫做可逆反应 电解水生成氢气和氧气与氢气和氧气点燃生成水的反应是可逆反应
降压时,平衡常数减小 升温时,平衡常数增大 降温时,平衡常数增大 降压时,平衡常数增大
催化剂V2O5不改变该反应的逆反应速率 增大反应体系的压强,反应速率一定增大 该反应是放热反应,降低温度将缩短反应达到平衡的时间 在t1、t2时刻,SO3(g)的浓度分别是c1,c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=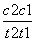
SO3的质量保持不变 SO2的百分含量保持不变 SO2和SO3的生成速率相等 SO2、O2、SO3的物质的量之比为2︰1︰2
降压时,平衡常数减小 升温时,平衡常数增大 降温时,平衡常数增大 降压时,平衡常数增大

 Br2+SO2↑+2H2O互为可逆反应 既能向正反应方向进行,又能向逆反应方向进行的反应叫做可逆反应 在同一条件下,同时向正、逆两个方向进行的反应叫做可逆反应 电解水生成氢气和氧气与氢气和氧气点燃生成水的反应是可逆反应
Br2+SO2↑+2H2O互为可逆反应 既能向正反应方向进行,又能向逆反应方向进行的反应叫做可逆反应 在同一条件下,同时向正、逆两个方向进行的反应叫做可逆反应 电解水生成氢气和氧气与氢气和氧气点燃生成水的反应是可逆反应