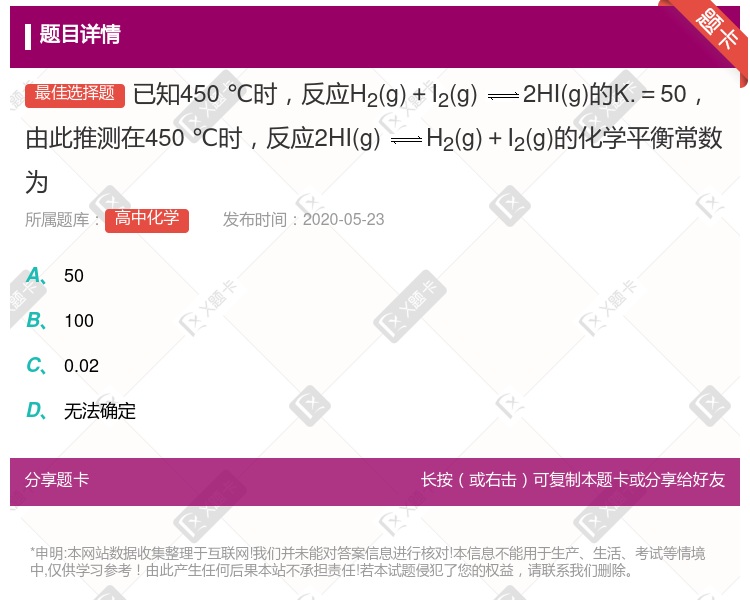
 2SO3,2体积SO2与足量O2反应,能生成2体积SO3 合成氨反应中使用催化剂,降低了反应所需要的活化能 反应H2(g)+I2 (g)
2SO3,2体积SO2与足量O2反应,能生成2体积SO3 合成氨反应中使用催化剂,降低了反应所需要的活化能 反应H2(g)+I2 (g)  2HI(g) 在450℃时,其平衡常数为49;则反应 HI(g)
2HI(g) 在450℃时,其平衡常数为49;则反应 HI(g)  1∕2 H2(g) +1∕2 I2(g) 在450℃时的平衡常数为1/7
1∕2 H2(g) +1∕2 I2(g) 在450℃时的平衡常数为1/7
 2SO3,2体积SO2与足量O2反应,能生成2体积SO3 合成氨反应中使用催化剂,降低了反应所需要的活化能。 反应H2(g)+I2(g)
2SO3,2体积SO2与足量O2反应,能生成2体积SO3 合成氨反应中使用催化剂,降低了反应所需要的活化能。 反应H2(g)+I2(g)  2HI(g) 在450℃时,其平衡常数为49;则反应 HI(g)
2HI(g) 在450℃时,其平衡常数为49;则反应 HI(g)  1 ∕ 2 H2(g) +1 ∕ 2 I2(g) 在450℃时的平衡常数为1 ∕ 7
1 ∕ 2 H2(g) +1 ∕ 2 I2(g) 在450℃时的平衡常数为1 ∕ 7