你可能感兴趣的试题
镁为负极 原电池中碳极的电极反应式为 电解池中阳极处先变红 电解池中阴极的电极反应式为
电解池中阳极处先变红 电解池中阴极的电极反应式为

a和b不连接时,铁片、铜片上均无反应发生 a和b用导线连接时,溶液中Cu2+ 向铁电极移动 a和b分别连接直流电源正、负极,铜电极质量减少 a和b分别连接直流电源正、负极,溶液中Cu2+ 向铜电极移动
X.和Y.不连接时,铜棒上会有金属银析出 X.和Y.用导线连接时,银棒是正极,发生氧化反应 若X.接直流电源的正极,Y.接负极,Ag+向铜电极移动 无论X.和Y.是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色
电化学腐蚀原理是电池作用原理 有电位不同的两个极 两极在同一电解质溶液中 在阴极发生氧化反应,在阳极发生还原反应
上述电化学装置相当于电解池 上述装置进行的总反应为2CO2=2CO+O2 反应结束后该电化学装置中的电解质溶液pH增大 失电子的电极发生的反应是4OH-﹣4e-=2H2O+O2↑
a、b不连接时,只有锌片上有气泡逸出 a和b用导线连接时,铜片上发生的反应为:2H+ + 2e-= H2↑ a和b用导线连接或接直流电源,锌片都能溶解 a和b是否用导线连接,装置中所涉及的化学反应都相同 
a和b不连接时,铁片上会有金属铜析出 a和b用导线连接时, Cu2+在铜片上得电子被氧化 a和b用导线连接时,电子由铁片经导线流向铜片,铁片发生氧化反应 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色
a和b不连接时,铁片上会有金属铜析出 a和b用导线连接时,铜片上发生的反应为Cu2++2e-===Cu 无论a和b是否连接,铁片均会溶解,溶液均从蓝色直接变成黄色 a连接直流电流正极,b连接直流电流负极,电压足够大时,Cu2+向铜电极移动 
金属的腐蚀是因为金属中含有杂质 化学腐蚀是最普遍的一类金属腐蚀 金属的电化学腐蚀与原电池的原理是一致的 电化学腐蚀过程中,金属中的杂质作负极
甲装置是电解池,乙装置是原电池 当甲中产生0.1 mol气体时,乙中析出固体的质量为6.4 g 实验一段时间后,甲烧杯中溶液的pH减小 将乙中的C.电极换成铜电极,则乙装置可变成电镀装置
a和b不连接时,铁片上会有金属铜析出 a和b用导线连接时,铁片上发生的反应为:Fe-2e-=Fe3+ a和b用导线连接时,电流从Cu片流向铁片 a和b用导线连接时,Cu2+向铜电极移动
X.和Y.不连接时,铜棒上会有金属银析出 X.和Y.用导线连接时,银棒是正极,发生氧化反应 若X.接直流电源的正极,Y.接负极,Ag+向铜电极移动 无论X.和Y.是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色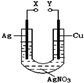
a和b不连接时,铁片上会有金属铜析出 a和b用导线连接时,铁片上发生的反应为: Fe-2e-=Fe2+ a和b用导线连接时电子从Cu片流向铁片 a和b用导线连接时,Cu2+向铜电极移动
镀锌铁表面有划损时,仍然能阻止铁被氧化 给手机电池充电时,应该将电源的正极与电池的正极相连 电化学腐蚀与化学腐蚀都是金属原子失去电子而被氧化的过程 电镀时,通常把电镀的金属制品作阳极,把镀层金属作阴极
a和b不连接时,铁片上会有金属铜析出 a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu a和b分别连接足够电压的直流电源正、负极时,Cu2+向铜电极移动 无论a和b是否用导线连接,铁片均溶解,溶液从蓝色逐渐变成浅绿色
a和b不连接时,铁片上会有金属铜析出 a和b用导线连接时,铜片上发生的反应为:Cu2++2e﹣=Cu 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
a和b不连接时,铁片上会有金属铜析出 a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu a和b分别连接足够电压的直流电源正、负极时,Cu2+向铜电极移动 无论a和b是否用导线连接,铁片均溶解,溶液从蓝色逐渐变成浅绿色

 电解池中阳极处先变红 电解池中阴极的电极反应式为
电解池中阳极处先变红 电解池中阴极的电极反应式为



