你可能感兴趣的试题
在pH=11的溶液中,水电离出的c(OH一)一定等于10-11mol/L 将pH=l的酸和pH=13的碱溶液等体积混合后,溶液的pH一定等于7 将物质的量浓度和体积都相同的一元酸HA与一元碱BOH混合后,溶液呈中性,则反应后溶液中c(H+)= 若强酸、强碱中和后溶液pH=7,则中和前酸、碱的pH之和一定等于14
若强酸、强碱中和后溶液pH=7,则中和前酸、碱的pH之和一定等于14
①溶液中:c(A-)>c(Na+)>c(OH-)>c(H+) ①溶液中:c(HA)+c(A-)=0.1mol/L 常温下,0.1mol/LHA溶液的pH=1 0.1mol/LHA溶液中:c(HA)>c(A-)
HA是一种强酸 x点,c(A-)=c(B-) HB是一种弱酸 原溶液中HA的物质的量浓度为HB的10倍
该温度下HB的电离平衡常数约为1.11×10-5 溶液中水的电离程度:a=c>b 相同条件下NaA溶液的pH大于NaB溶液的pH 当 时,若同时微热两种溶液(不考虑HA.HB和H2O的挥发),则
时,若同时微热两种溶液(不考虑HA.HB和H2O的挥发),则 减小
减小
若V1>V2,则说明HA的酸性比HB的酸性强 若V1>V2,则说明HA的酸性比HB的酸性弱 因为两种酸溶液的pH相等,故V1一定等于V2 若将两种酸溶液等体积混合,混合酸溶液的pH一定等于2
HA.HB都是弱酸 在M.点,c( )=c(
)=c(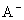 ) 稀释前,c(HA)=10c(HB) 在M.点,HA.HB酸的电离常数相同
) 稀释前,c(HA)=10c(HB) 在M.点,HA.HB酸的电离常数相同
HA是一种强酸 x点,[A-]=[B-] HB是一种弱酸 原溶液中HA的物质的量浓度为HB的10倍 
HA是强酸,HB是弱酸 升高温度,溶液②中 增大 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+) 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol·L-1
增大 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+) 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol·L-1
甲表示1mol H2 (g)完全燃烧生成水蒸气吸收241.8 kJ热量 甲表示2 mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ 乙表示常温 下,稀释HA.HB两种酸的稀溶液时,溶液pH随加水量的变化,则同温同浓度的NaA溶液的pH小于NaB溶液的pH 乙图中起始时HA的物质的量浓度大于HB
等物质的量浓度的HA溶液与NaB溶液等体积的混合液中: 2c(Na+) =c(A-)+c(B-)+c(HA)+c(HB) pH相等的NaA与KB两溶液中:[c(Na+)-c(A-)] < [c(K+)-c(B-)] pH=9的三种溶液 ①NaB ②NH3·H2O ③NaOH中由水电离出的c(OH-):①>②>③ 两种溶液① 0.1mol/L HA溶液 ②0.1mol/L HB溶液,加水稀释至pH 相同,需加水的量前者小于后者
HA是强酸,HB是弱酸 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+) 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol·L-1 升高温度,溶液②中 增大
增大
甲表示1mol H2 (g)完全燃烧生成水蒸气吸收241.8 kJ热量 甲表示2 mol H2(g)所具有的能量一定比2 mol气态水所具有的能量多483.6 kJ 乙表示常温 下,稀释HA.HB两种酸的稀溶液时,溶液pH随加水量的变化,则同温同浓度的NaA溶液的pH小于NaB溶液的pH 乙图中起始时HA的物质的量浓度大于HB
HB是一种弱酸 稀释前,c(HA)<10c(HB) 在NaB和HB的混合溶液中一定存在: c(B-)>c(Na+)>c(H+)>c(OH-) 在M.点的两种溶液中: c(B-)=c(A-),且c(B-)+c(H+)>c(A-)+c(OH-) 
图甲表示l mol H2(g)完全燃烧生成水蒸气吸收241.8 kJ热量 图甲表示2 mol H2(g)所具有的能量比2 mol H2O(g)所具有的能量多483.6 kJ 图乙表示常温下稀释HA.HB两种酸的图像,得出结论:HA的酸性大于HB的酸性 图乙中起始时HA的物质的量浓度大于HB
有气体参加的化学反应,若增大压强(缩小反应容器的容积),可增大活化分子的百分数,从而使反应速率增大。 凡是焓变小于零的反应都能自发进行。 对于常温下浓度相同的两种弱酸HA和HB,电离常数大的酸溶液的酸性强,电离常数小的酸溶液的酸性弱。 强电解质溶液的导电能力一定比弱电解质溶液的强
图甲表示l mol H2(g)完全燃烧生成水蒸气吸收241.8 kJ热量 图甲表示2 mol H2(g)所具有的能量比2 mol H2O(g)所具有的能量多483.6 kJ 图乙表示常温下稀释HA.HB两种酸的图像,得出结论:HA的酸性大于HB的酸性 图乙中起始时HA的物质的量浓度大于HB
图甲表示1mol H2 (g)完全燃烧生成水蒸气吸收241.8 kJ热量 图甲表示2 mol H2(g)所具有的能量比2 molH2O(g)所具有的能量多483.6 kJ 图乙表示常温下稀释HA.HB两种酸的稀溶液时,溶液pH随加水量的变化,则同温、同浓度的NaA溶液的pH小于NaB溶液的pH 图乙中起始时HA的物质的量浓度大于HB
HA是强酸,HB是弱酸 升高温度,溶液②中增大 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+) 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol·L-1

 若强酸、强碱中和后溶液pH=7,则中和前酸、碱的pH之和一定等于14
若强酸、强碱中和后溶液pH=7,则中和前酸、碱的pH之和一定等于14
 时,若同时微热两种溶液(不考虑HA.HB和H2O的挥发),则
时,若同时微热两种溶液(不考虑HA.HB和H2O的挥发),则 减小
减小
 )=c(
)=c(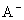 ) 稀释前,c(HA)=10c(HB) 在M.点,HA.HB酸的电离常数相同
) 稀释前,c(HA)=10c(HB) 在M.点,HA.HB酸的电离常数相同

 增大 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+) 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol·L-1
增大 溶液①中离子浓度的关系:c(A-)>c(Na+)>c(OH-)>c(H+) 溶液②中离子浓度的关系:c(Na+)+c(H+)+c(B-)=0.12 mol·L-1
 增大
增大
