
 ×100% 上述溶液中再加入V. mL水后,所得溶液溶质的质量分数大于0.5w 上述溶液中再加入相同质量的水后,所得溶液的物质的量浓度变为原来一半 溶质的物质的量浓度c=
×100% 上述溶液中再加入V. mL水后,所得溶液溶质的质量分数大于0.5w 上述溶液中再加入相同质量的水后,所得溶液的物质的量浓度变为原来一半 溶质的物质的量浓度c= mol·L-1
mol·L-1
 ×100% 溶质的物质的量浓度c=
×100% 溶质的物质的量浓度c= mol·L.-1 溶液中c(OH-)=
mol·L.-1 溶液中c(OH-)=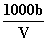 mol·L.-1+c(H+) 向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w
mol·L.-1+c(H+) 向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w
 用水稀释该溶液,OH-的物质的量增加 该溶液中共有6种微粒 上述溶液中再加入V. mL水后,所得溶液溶质的质量分数大于0.5w
用水稀释该溶液,OH-的物质的量增加 该溶液中共有6种微粒 上述溶液中再加入V. mL水后,所得溶液溶质的质量分数大于0.5w
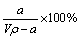 溶质的物质的量浓度
溶质的物质的量浓度 溶液中c(OH—)=
溶液中c(OH—)= 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
 ×100% 溶质的物质的量浓度c=a/17V mol·L-1 溶液中c(OH-)=1000b/V mol·L-1 上述溶液中再加入V. mL水后,所得溶液溶质的质量分数小于0.5w
×100% 溶质的物质的量浓度c=a/17V mol·L-1 溶液中c(OH-)=1000b/V mol·L-1 上述溶液中再加入V. mL水后,所得溶液溶质的质量分数小于0.5w
 ×100% 溶质的物质的量浓度c=
×100% 溶质的物质的量浓度c= mol/L 溶液中c(OH-)=
mol/L 溶液中c(OH-)= mol/L+c(H+) 向上述溶液中加入V. mL水,所得溶液的质量分数大于0.5w
mol/L+c(H+) 向上述溶液中加入V. mL水,所得溶液的质量分数大于0.5w
 上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w 溶液中
上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w 溶液中 溶质的物质的量浓度
溶质的物质的量浓度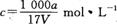
 mol·L-1 1 mol·L-1的硫酸溶液中c(H+)=1 mol·L-1
mol·L-1 1 mol·L-1的硫酸溶液中c(H+)=1 mol·L-1
 mol·L.-1 溶质的质量分数为w=
mol·L.-1 溶质的质量分数为w= ×100% 溶液中c(NH3)=
×100% 溶液中c(NH3)= mol·L.-1 上述溶液中再加入V. mL水后,所得溶液的质量分数大于0.5w
mol·L.-1 上述溶液中再加入V. mL水后,所得溶液的质量分数大于0.5w
 溶质的物质的量浓度
溶质的物质的量浓度 溶液中c(OH-)=
溶液中c(OH-)= 上述溶液中再加入V.mL水后,所得溶液的质量分数大于0.5ω
上述溶液中再加入V.mL水后,所得溶液的质量分数大于0.5ω
 上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于O..5w 溶液中
上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于O..5w 溶液中 溶质的物质的量浓度
溶质的物质的量浓度
 ×100% 溶质的物质的量浓度c=
×100% 溶质的物质的量浓度c= mol·L-1 溶液中c(OH-)=
mol·L-1 溶液中c(OH-)= mol·L-1 上述溶液中再加入V. mL水后,所得溶液溶质的质量分数大于0.5w
mol·L-1 上述溶液中再加入V. mL水后,所得溶液溶质的质量分数大于0.5w
 溶质的物质的量浓度
溶质的物质的量浓度 mol/L 溶液中
mol/L 溶液中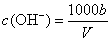 mol/L 题述溶液中再加入V.mL水后,所得溶液的质量分数大于0.5ω
mol/L 题述溶液中再加入V.mL水后,所得溶液的质量分数大于0.5ω
 ×100% 溶质的物质的量浓度c=
×100% 溶质的物质的量浓度c=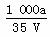 mol·L.-1 溶液中c(OH-)=
mol·L.-1 溶液中c(OH-)= mol·L.-1+c(H+) 向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w
mol·L.-1+c(H+) 向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w
 ×100% 溶质的物质的量浓度c=
×100% 溶质的物质的量浓度c= mol·L.-1 溶液中c(OH-)=
mol·L.-1 溶液中c(OH-)= mol·L.-1+c(H+) 向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w
mol·L.-1+c(H+) 向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w